
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+ 11O2= 4B2O3+ 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
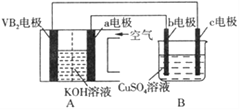
A. VB2电极发生的电极反应为:2VB2+ 11H2O - 22e-= V2O5+ 2B2O3+ 22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,c电极表面先有红色物质析出,b电极有气泡产生
D. 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1mol/L
【答案】C
【解析】A. A装置为原电池,其中a电极得电子为正极,VB2电极为负极,发生的电极反应为:2VB2+ 22OH- - 22e-= V2O5+ 2B2O3+ 11H2O,故A错误;B. 外电路中电子由VB2电极流向c电极,故B错误;C. 电解过程中,c为阴极,发生还原反应,先生成铜,后产生氢气,电极表面先有红色物质析出,后有气泡产生,b电极为阳极,失去电子发生氧化反应,有O2产生,故C正确;D. B装置内共收集到气体为0.448L,即0.02mol,此时外电路通过电子为0.04mol,电解硫酸铜溶液的反应:2CuSO4+2H2O==2Cu+2H2SO4+O2↑经过计算可知,若硫酸铜没有耗尽,生成的气体仅为O2,则当外电路通过0.04mol电子时,生成氧气为0.01mol,因此此时硫酸铜已经耗尽,反应开始电解水。当外电路通过0.04mol电子时,生成氧气为0.01mol,因此电解水生成氧气为0.005mol,电解硫酸铜溶液生成氧气为0.005mol,所以硫酸铜的物质的量为0.01mol,硫酸铜的物质的量为![]() =0.05mol/L,故D错误;综合以上分析,本题正确答案为C。
=0.05mol/L,故D错误;综合以上分析,本题正确答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某无机盐除结晶水外,还含两种阳离子和一种阴离子,摩尔质量为392 g·mol1,为探究其组成和性质,设计并完成了如下实验:
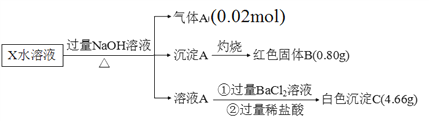
请回答:
(1)X的化学式为_______________。
(2)生成红褐色沉淀A的反应方程式____________________________________________。
(3)检验X溶液中金属阳离子的方法为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因成功提取青蒿素而获得诺贝尔奖。已知青蒿素分子结构如下图所示,下列说法中不正确的是

A. 青嵩素分子中所有的碳原子不可能在同一平面内
B. 青嵩素在酸或碱催化条件下可以水解
C. 青蒿素分子含三种官能团,分子结构稳定,受热不易分解
D. 青蒿素难溶于水,可采用有机溶剂萃取后蒸馏提取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是
(3)D是由两种元素组成的三原子分子,电子式是
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式
(5)E+F→C+D写出该方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38.Y元素原子最外层电子数占核外总电子数的 ![]() ;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
(1)写出元素符号:X , Y , Z , W .
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是 .
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是 , 反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 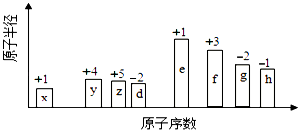
根据判断出的元素回答问题:
(1)f 在元素周期表的位置是;g的离子结构示意图为 .
(2)在z、d、e、f 四种元素中,其离子半径按由大到小的排列顺序为(用 化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性较强的是: .
(3)由x和z元素组成一种四原子共价化合物,写出其电子式 .
(4)由x、z、h三种元素构成的盐,其水溶液显酸性,用离子方程式解释其原因 .
(5)已知1mol e 的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】字母A﹣F代表六种不同物质,它们之间可发生如图的转化(部分反应中生成物没有全部列出).其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧.分析图示回答下列问题: 
(1)A可以是或;
(2)E在CO2中燃烧的化学方程式为;
(3)D与F反应的化学方程式为 , 该反应中D表现了性;
(4)50mL 14molL﹣1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为mol,参加反应的铜的质量为g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com