
【题目】我国科学家屠呦呦因成功提取青蒿素而获得诺贝尔奖。已知青蒿素分子结构如下图所示,下列说法中不正确的是

A. 青嵩素分子中所有的碳原子不可能在同一平面内
B. 青嵩素在酸或碱催化条件下可以水解
C. 青蒿素分子含三种官能团,分子结构稳定,受热不易分解
D. 青蒿素难溶于水,可采用有机溶剂萃取后蒸馏提取
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有Na+、CO32-、HCO3-、SO32-、Cl-,在加入Na2O2后浓度不发生变化的是
A. Na+、CO32- B. Cl- C. CO32-、Cl- D. HCO3-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( ) 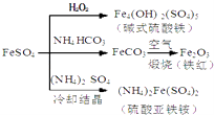
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
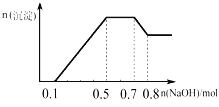
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中一定不含CO32﹣,一定含有SO42﹣和NO3﹣
C. 溶液中n(NH4+)=0.25mol
D. 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质有关用途与性质的对应关系错误的是( )
物质 | 用途 | 性质 | |
A | 小苏打 | 用于焙制糕点 | 小苏打能与碱反应 |
B | 金属钠 | 用于冶炼钛、锆等金属 | 金属钠有强还原性 |
C | 二氧化硫 | 常用于漂白秸秆、织物 | SO2能跟其中的有色物质结合 |
D | 铁粉 | 用于食品中的脱氧剂 | Fe具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
A.950 mL 111.2 g
B.500 mL 117 g
C.1 000 mL 117 g
D.任意规格 111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
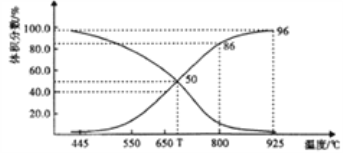
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+ 11O2= 4B2O3+ 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
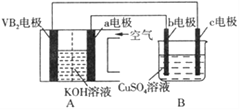
A. VB2电极发生的电极反应为:2VB2+ 11H2O - 22e-= V2O5+ 2B2O3+ 22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,c电极表面先有红色物质析出,b电极有气泡产生
D. 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com