
【题目】某溶液中含有Na+、CO32-、HCO3-、SO32-、Cl-,在加入Na2O2后浓度不发生变化的是
A. Na+、CO32- B. Cl- C. CO32-、Cl- D. HCO3-、SO32-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)
(1)锂电池放电时电池的反应式为_____________________________。
(2)该电池工作时,Li+向________(填“正极”或“负极”)迁移。
(3)假设放电过程中消耗负极材料5.6g,则转移的电子数目为_______(NA为阿伏加德罗常数的值)。
科学家设想利用太阳能电池电解水产生的气体制成燃料电池给卫星充电,可建立环保型的卫星供电系统。
(4)已知破坏1molH-H键、1molO=O键、1molH-O键时分别需要吸收436kJ、498kJ、465kJ的能量。下图表示H2、O2转化为水的反应过程能量变化,则b=______。
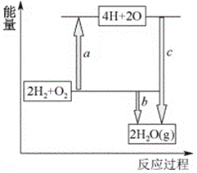
(5)若该氢氧燃料电池的电解质溶液为酸性溶液,电池总反应为2H2+O2=2H2O。该电池的正极反应为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】613C-NMR(核磁共振)可以用于含碳化合物的结构分析,613C表示的碳原子( )
A.核外有13个电子B.核内有6个质子,核外有7个电子
C.质量数为13,核内有7个质子D.质量数为13,核内有7个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上重要里程碑之一。下列有关元素周期表的说法正确的是
A. 元素周期表有7个横行、18个纵行,即有7个周期、18个族
B. 俄罗斯专家首次合成了![]() 原子,116号元素位于元素周期表中第7周期VIA族
原子,116号元素位于元素周期表中第7周期VIA族
C. 只有第IIA族元素的原子最外层有2个电子
D. IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一酸两浸,两碱联合”法是实现粉煤灰(含SiO2、Al2O3、Fe2O3、CaO、MgO等)综合利用的新工艺。工业流程如下:
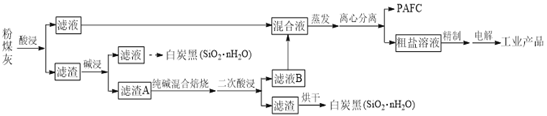
回答下列问题:
(1)聚合氯化铝铁(PAFC)化学式为[Al2(OH)nCl6-n]m·[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂,PAFC中铁元素的化合价为___________。
(2)“一酸两浸”中的酸是________________(填化学式)。
(3)实际工业中“酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为__________、________。
(4)“滤液B”的主要溶质有_________(填化学式)。滤液混合后“蒸发”的作用是__________________。
(5)“电解”时阳极的电极反应式为_______________。
(6)PAFC、无水AlCl3、FeCl3·6H2O用量均为25 mg·![]() 时,处理不同pH污水的浊度去除率如图所示,PAFC的优点是________。
时,处理不同pH污水的浊度去除率如图所示,PAFC的优点是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)难溶于水,常用作催化剂、气体吸收剂及脱氯剂等。
(1)向一定比例的CuSO4、NaCl溶液中持续加入一定浓度的Na2SO3溶液可制得CuCl。加入的Na2SO3溶液体积与溶液pH关系如图所示。
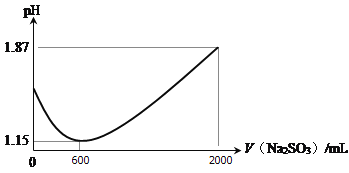
① 0 ~ 600 mL时pH降低的原因是________________________(用离子方程式表示);
② 600 ~ 2000 mL的过程中有刺激性气味的气体产生,该气体是__________。
(2)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 molL-1的CuCl2溶液中加入足量的铜,___(填“能”或“不能”)生成CuCl,写出计算过程_____。
(3)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g) ![]() CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A.降低温度 B.增大压强
C.延长反应时间 D.把CuCl分散到疏松多孔的分子筛中
(4)已知: CuCl ![]() Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl-![]() CuCl2- K2;
CuCl2- K2;
①反应Cu++2Cl-![]() CuCl2-的平衡常数K=________________(用K1、K2表示)。
CuCl2-的平衡常数K=________________(用K1、K2表示)。
②用平衡移动原理解释CuCl易溶于浓盐酸的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无机盐除结晶水外,还含两种阳离子和一种阴离子,摩尔质量为392 g·mol1,为探究其组成和性质,设计并完成了如下实验:
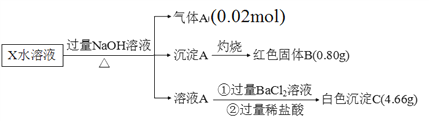
请回答:
(1)X的化学式为_______________。
(2)生成红褐色沉淀A的反应方程式____________________________________________。
(3)检验X溶液中金属阳离子的方法为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因成功提取青蒿素而获得诺贝尔奖。已知青蒿素分子结构如下图所示,下列说法中不正确的是

A. 青嵩素分子中所有的碳原子不可能在同一平面内
B. 青嵩素在酸或碱催化条件下可以水解
C. 青蒿素分子含三种官能团,分子结构稳定,受热不易分解
D. 青蒿素难溶于水,可采用有机溶剂萃取后蒸馏提取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com