
【题目】氯化亚铜(CuCl)难溶于水,常用作催化剂、气体吸收剂及脱氯剂等。
(1)向一定比例的CuSO4、NaCl溶液中持续加入一定浓度的Na2SO3溶液可制得CuCl。加入的Na2SO3溶液体积与溶液pH关系如图所示。
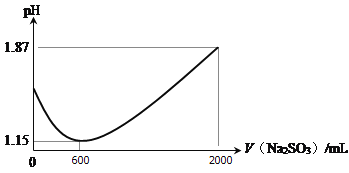
① 0 ~ 600 mL时pH降低的原因是________________________(用离子方程式表示);
② 600 ~ 2000 mL的过程中有刺激性气味的气体产生,该气体是__________。
(2)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 molL-1的CuCl2溶液中加入足量的铜,___(填“能”或“不能”)生成CuCl,写出计算过程_____。
(3)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g) ![]() CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A.降低温度 B.增大压强
C.延长反应时间 D.把CuCl分散到疏松多孔的分子筛中
(4)已知: CuCl ![]() Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl-![]() CuCl2- K2;
CuCl2- K2;
①反应Cu++2Cl-![]() CuCl2-的平衡常数K=________________(用K1、K2表示)。
CuCl2-的平衡常数K=________________(用K1、K2表示)。
②用平衡移动原理解释CuCl易溶于浓盐酸的原因_____________________________。
【答案】 ①2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+ SO2 能 Qc=![]() =2.5×105<K AB
=2.5×105<K AB ![]() c(Cl-)增大,CuCl+Cl-
c(Cl-)增大,CuCl+Cl-![]() CuCl2-平衡正向移动,CuCl溶解
CuCl2-平衡正向移动,CuCl溶解
【解析】(1)①CuSO4、NaCl溶液中持续加入一定浓度的Na2SO3溶液可制得CuCl,发生了氧化还原反应,离子方程式为:2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+,随反应进行,氢离子浓度增大,pH变小;②继续加入亚硫酸钠溶液,消耗氢离子,产生二氧化硫气体,pH值增大;(2)向0.01 molL-1的CuCl2溶液中加入足量的铜,假设CuCl2全部反应,则Qc=1/c(Cu2+)c2(Cl—)= ![]() =2.5×105<K,反应正向进行,能生成CuCl。
=2.5×105<K,反应正向进行,能生成CuCl。
(3)因正反应是放热反应,降低温度,平衡正向移动,CO的平衡转化率增大,A正确;增大压强,平衡向正向移动,CO的平衡转化率增大,B正确;达到平衡后延长反应时间,仅增大产率,C错误;把CuCl分散到疏松多孔的分子筛中,增大反应速率,不影响CO的平衡转化率,D错误;故选AB。(4)反应Cu++2Cl-![]() CuCl2-,可以看成①CuCl
CuCl2-,可以看成①CuCl ![]() Cu++Cl-、②CuCl+Cl-
Cu++Cl-、②CuCl+Cl-![]() CuCl2-之差,即②-①,则此反应平衡常数K=
CuCl2-之差,即②-①,则此反应平衡常数K=![]() ;c(Cl-)增大,CuCl+Cl-
;c(Cl-)增大,CuCl+Cl-![]() CuCl2-平衡正向移动,CuCl溶解。
CuCl2-平衡正向移动,CuCl溶解。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: 
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学研究的重要方法,下列物质分类错误的是()
A.化合物:干冰、明矾、烧碱B.同位素:石墨、C60、金刚石
C.混合物:漂白粉、纯净矿泉水、盐酸D.非电解质:乙醇、四氯化碳、甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Na+、CO32-、HCO3-、SO32-、Cl-,在加入Na2O2后浓度不发生变化的是
A. Na+、CO32- B. Cl- C. CO32-、Cl- D. HCO3-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 钠和钾的合金可用于快中子反应堆作热交换剂
B. 可用超纯硅制造的单晶硅来制造芯片
C. 电解饱和食盐水可制得黄绿色的氯气
D. 氯气有毒,不能用于药物的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模拟足贝类足丝蛋白的功能,合成了一种对云母、玻璃、二氧化硅等材料具有良好粘附性的物质──化合物I,其合成路线如下:

回答下列问题:
(1)A的化学名称为___________________。
(2)由B生成C的化学方程式为_______________________________________________。
(3)由E和F反应生成D的反应类型为________________,由G和H反应生成I的反应类型为________________。
(4)D的结构简式为__________,仅以D为单体合成高分子化合物的化学方程式为___________________________________________________________。
(5)I的分子式为_____________________。
(6)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH4+、CO32、Cl、SO32、SO42。某同学为确定其成分,设计并完成以下实验(不考虑水解,所加试剂均足量):
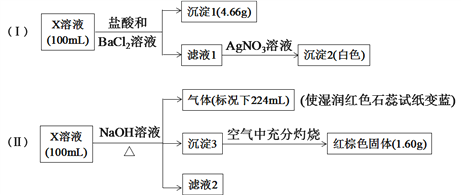
下列说法正确的是
A. X溶液中一定存在Na+、SO32、SO42、CO32
B. X溶液中一定存在NH4+、Na+、SO42,至少含有Fe3+、Fe2+离子中的一种
C. 取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+
D. X溶液中一定含有Cl,且c(Cl)≥0.1mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( ) 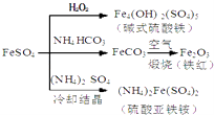
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
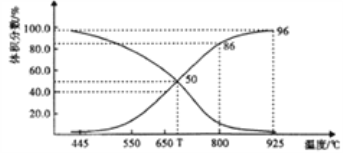
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com