
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: 
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
【答案】
(1)0.1mol
(2)0.1mol?L﹣1
【解析】解:(1)根据MgCl2的物质的量浓度=镁离子浓度=0.5 molL﹣1 , MgCl2的物质的量=0.5 molL﹣1×0.2L=0.1mol,故答案为:0.1mol;(2)溶液中的电荷守恒:c(Na+)×1+c(Mg2+)×2+c(Ca2+)×2=c(Cl﹣)×1,1.0 molL﹣1 +0.5 molL﹣1×2+c(Ca2+)×2=3 molL﹣1×1,c(Ca2+)=0.5 molL﹣1 , c(CaCl2)=0.5 molL﹣1 , 稀释后溶液中Ca2+的物质的量浓度为 ![]() =0.1 molL﹣1 , 故答案为:0.1mol;0.1 molL﹣1 . (1)先根据MgCl2的物质的量浓度=镁离子浓度来计算浓度,再根据n=cV计算;(2)根据稀释前后溶质的物质的量不变,利用C=
=0.1 molL﹣1 , 故答案为:0.1mol;0.1 molL﹣1 . (1)先根据MgCl2的物质的量浓度=镁离子浓度来计算浓度,再根据n=cV计算;(2)根据稀释前后溶质的物质的量不变,利用C= ![]() 来解答.
来解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用A+、B﹣、C2﹣、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示).
(2)D是由两种元素组成的双原子分子,用电子式表示其形成过程________.
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________,其与水反应的化学方程式为________.
(4)F分子中含有6个原子,其化学式是________或________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期的主族元素,原子序数依次增大,A是IA族的非金属元素,B元素的最高价氧化物的水化物与其简单气态氢化物可反应生成盐,C是短周期中原子半径最大的元素,D元素原子L层电子数和M层电子数之差等于B元素最外层电子数,E元素最高正价和最低负价代数和等于4,据此回答下列问题:
(1)F元素在周期表中的位置__________,C原子结构示意图______________。
(2)A、B两元素可形成18电子的分子,该分子的电子式为_______________。
(3)A和氧元素形成的简单化合物,其熔沸点高于A和E形成的简单化合物,原因是____________。
(4)C、D、F可形成复杂化合物C[DF4],该化合物含有的化学键类型为________________。
(5)仅有上述元素形成的化合物或单质间的某些反应,可用以说明E和F两元素非金属性的强弱,写出其中一个离子反应方程式__________________________________。
(6)写出C、D两元素最高价氧化物的水化物反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用纯碱溶液溶解苯酚:CO32﹣+C6H5OH→C6H5O﹣+HCO3﹣
B.用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH﹣═2NO3﹣+H2O
C.用二氧化锰和浓盐酸反应制氯气:MNO2+4HCl(浓) ![]() Mn2++2Cl﹣+Cl2↑+2H2O
Mn2++2Cl﹣+Cl2↑+2H2O
D.向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O═AlO2﹣+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝混合物投到2molL﹣1的盐酸中,待金属完全溶解后,向溶液中加入2molL﹣1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: 
(1))80~90mL对应反应的离子方程式 .
(2)金属铝的质量为
(3)盐酸的体积是mL.
(4)a的取值范围是 .
(5)n(Mg)/n(Al)的最大值是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
A.若分子数相等,则体积相等
B.若原子数相等,则中子数相等
C.若质量相等,则质子数相等
D.若体积相等,则质量数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)
(1)锂电池放电时电池的反应式为_____________________________。
(2)该电池工作时,Li+向________(填“正极”或“负极”)迁移。
(3)假设放电过程中消耗负极材料5.6g,则转移的电子数目为_______(NA为阿伏加德罗常数的值)。
科学家设想利用太阳能电池电解水产生的气体制成燃料电池给卫星充电,可建立环保型的卫星供电系统。
(4)已知破坏1molH-H键、1molO=O键、1molH-O键时分别需要吸收436kJ、498kJ、465kJ的能量。下图表示H2、O2转化为水的反应过程能量变化,则b=______。
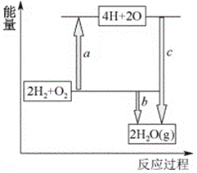
(5)若该氢氧燃料电池的电解质溶液为酸性溶液,电池总反应为2H2+O2=2H2O。该电池的正极反应为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)难溶于水,常用作催化剂、气体吸收剂及脱氯剂等。
(1)向一定比例的CuSO4、NaCl溶液中持续加入一定浓度的Na2SO3溶液可制得CuCl。加入的Na2SO3溶液体积与溶液pH关系如图所示。
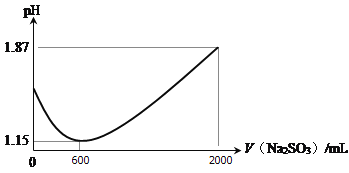
① 0 ~ 600 mL时pH降低的原因是________________________(用离子方程式表示);
② 600 ~ 2000 mL的过程中有刺激性气味的气体产生,该气体是__________。
(2)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 molL-1的CuCl2溶液中加入足量的铜,___(填“能”或“不能”)生成CuCl,写出计算过程_____。
(3)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g) ![]() CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A.降低温度 B.增大压强
C.延长反应时间 D.把CuCl分散到疏松多孔的分子筛中
(4)已知: CuCl ![]() Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl-![]() CuCl2- K2;
CuCl2- K2;
①反应Cu++2Cl-![]() CuCl2-的平衡常数K=________________(用K1、K2表示)。
CuCl2-的平衡常数K=________________(用K1、K2表示)。
②用平衡移动原理解释CuCl易溶于浓盐酸的原因_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com