
【题目】一定质量的镁、铝混合物投到2molL﹣1的盐酸中,待金属完全溶解后,向溶液中加入2molL﹣1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: 
(1))80~90mL对应反应的离子方程式 .
(2)金属铝的质量为
(3)盐酸的体积是mL.
(4)a的取值范围是 .
(5)n(Mg)/n(Al)的最大值是 .
【答案】
(1)Al(OH)3+OH﹣=AlO2﹣+2H2O
(2)0.54g
(3)80
(4)0≤a<50
(5)2.5
【解析】解:0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁,(1)根据分析可知,80~90mL对应反应的离子方程式:Al(OH)3+OH﹣=AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;(2)从横坐标80mL到90mL这段可以得出:n(Al(OH)3)=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,原混合物中铝的质量为:27g/mol×0.02mol=0.54g,所以答案是:0.54;(3)加入80mL氢氧化钠溶液时,溶质为NaCl,则:n(HCl)=n(NaOH)=2mol/L×0.08L=0.16mol,盐酸的体积为: ![]() =0.08L=80mL,所以答案是:80;(4)假设盐酸溶解金属后没有剩余,此时酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要消耗NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,所以答案是:0≤a<50;(5)n(Al)=n(Al(OH)3)=2molL﹣1×0.01L=0.02mol,所以沉淀Al3+需要消耗的OH﹣为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为(80﹣a)mL,若假设盐酸没有剩余,所以沉淀Mg2+需要NaOH溶液的体积最大值为:80mL﹣30mL=50mL,n(Mg)的最大值为:
=0.08L=80mL,所以答案是:80;(4)假设盐酸溶解金属后没有剩余,此时酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要消耗NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,所以答案是:0≤a<50;(5)n(Al)=n(Al(OH)3)=2molL﹣1×0.01L=0.02mol,所以沉淀Al3+需要消耗的OH﹣为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为(80﹣a)mL,若假设盐酸没有剩余,所以沉淀Mg2+需要NaOH溶液的体积最大值为:80mL﹣30mL=50mL,n(Mg)的最大值为: ![]() =0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为:0.05mol:0.02mol=2.5,所以答案是:2.5.
=0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为:0.05mol:0.02mol=2.5,所以答案是:2.5.


科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.已知A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是电子层数的3倍,C+和D3+离子的电子层结构相同,B与E属于同一主族.请回答下列问题:
(1)E在元素周期表中的位置是________
(2)上述元素形成的简单离子中,半径最小的是________(填离子符号).
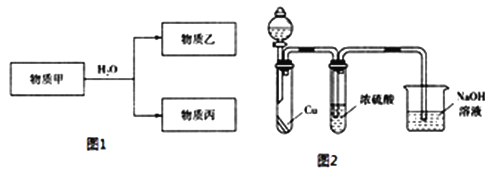
(3)由上述元素中的一种或几种组成的物质甲可以发生如图1反应:
①若乙具有漂白性,则乙的电子式为________.
②若丙的水溶液是强碱性溶液,则甲为______________(填化学式).
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为________;用电离方程式表示丙既能溶于强酸、又能溶于强碱的原因________.
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确.用如图2装置进行实验时,分液漏斗中应加入________(填试剂名称).实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铬和铁的活泼性,设计如图所示装置,下列推断合理的是( ) 
A.若铬比铁活泼,则电子经外电路由铁电极流向铬电极
B.若铬比铁活泼,则铁电极反应式为2H++2e﹣=H2↑
C.若铁比铬活泼,则溶液中H+向铁电极迁移
D.若铁电极附近溶液pH增大,则铁比铬活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: 
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱迪生蓄电池在充电和放电时发生反应Fe+ NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列对该电池的推断正确的是( )
Fe(OH)2+Ni(OH)2,下列对该电池的推断正确的是( )
A. 放电时,NiO2在正极被氧化
B. 放电时,电解质溶液中的阳离子向负极移动
C. 放电时,负极上的电极反应式为Fe + 2H2O —2e- = Fe(OH)2 +2H+
D. 该蓄电池的电极必须浸入某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
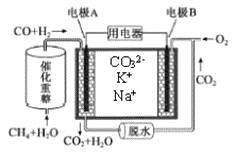
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol e-
3H2+CO,每消耗1molCH4转移12mol e-
B. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
C. 电池工作时,CO32-向电极B移动
D. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用100mL 1mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化).为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验.请帮助他们完成下列相应实验内容.
(1)[提出假设] 假设Ⅰ:溶液A的溶质为NaOH、Na2CO3;
假设Ⅱ:溶液A的溶质为Na2CO3;
假设Ⅲ:溶液A的溶质为Na2CO3、NaHCO3;
假设Ⅳ:溶液A的溶质为 .
(2)[实验过程] (i)甲同学取少量溶液A于试管,再向试管中滴加几滴酚酞溶液,溶液A变红,由此得出假设I成立.
(ii)乙同学分析后认为甲同学的实验结论有误.请用离子方程式说明乙同学的判断依据;他进一步提出,应先取少量溶液,向其中加入足量的溶液,来检验溶液A是否含 , 结果加入检验溶液后观察到溶液A变浑浊.
(iii)丙同学为了检验溶液A是否还含其它溶质,他将乙同学所得浑浊溶液进行过滤,并把滤液分为两份,向其中的一份加入稀硫酸,有无色气体生成,则假设正确.
(iv)为准确测定a值,丁同学取了10mL 溶液A在锥形瓶中,用滴定管向其中加入某浓度的稀硫酸,记录加入硫酸的体积与生成气体的情况,并绘制成如图:则a= , 所加硫酸的物质的量浓度为 . 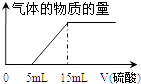
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模拟足贝类足丝蛋白的功能,合成了一种对云母、玻璃、二氧化硅等材料具有良好粘附性的物质──化合物I,其合成路线如下:

回答下列问题:
(1)A的化学名称为___________________。
(2)由B生成C的化学方程式为_______________________________________________。
(3)由E和F反应生成D的反应类型为________________,由G和H反应生成I的反应类型为________________。
(4)D的结构简式为__________,仅以D为单体合成高分子化合物的化学方程式为___________________________________________________________。
(5)I的分子式为_____________________。
(6)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com