
【题目】用A+、B﹣、C2﹣、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示).
(2)D是由两种元素组成的双原子分子,用电子式表示其形成过程________.
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________,其与水反应的化学方程式为________.
(4)F分子中含有6个原子,其化学式是________或________.
【答案】 K Cl S ![]() →
→ ![]() F2 2F2+2H2O=4HF+O2 N2H4 CH4O
F2 2F2+2H2O=4HF+O2 N2H4 CH4O
【解析】![]() 微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去
微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去![]() 的对应离子;二是第四周期的金属阳离子;三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子
的对应离子;二是第四周期的金属阳离子;三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子![]() 、
、![]() ;阴离子
;阴离子![]() 、
、![]() 、
、![]() 、
、![]() ;分子有Ar、HCl、
;分子有Ar、HCl、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等。
等。
(1)含有![]() 的
的![]() 、
、![]() 、
、![]() 分别为
分别为![]() 、
、![]() 、
、![]() ,所以A元素为K,B元素为Cl,C元素为S,正确答案:K,Cl,S。
,所以A元素为K,B元素为Cl,C元素为S,正确答案:K,Cl,S。
(2)![]() 微粒中由两种元素组成的双原子分子为HCl, HCl为共价化合物,电子式表示形成过程为
微粒中由两种元素组成的双原子分子为HCl, HCl为共价化合物,电子式表示形成过程为![]() →
→![]() ,正确答案:
,正确答案:![]() →
→![]() 。
。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,则该物质是![]() ;
;![]() 与水反应生成HF和氧气,其反应方程式为: 2F2+2H2O=4HF+O2;正确答案: F2 ;2F2+2H2O=4HF+O2 。 (4) F分子中含有6个原子,且满足
与水反应生成HF和氧气,其反应方程式为: 2F2+2H2O=4HF+O2;正确答案: F2 ;2F2+2H2O=4HF+O2 。 (4) F分子中含有6个原子,且满足![]() 微粒可能是N2H4 或CH4O;正确答案:N2H4 或CH4O。
微粒可能是N2H4 或CH4O;正确答案:N2H4 或CH4O。


科目:高中化学 来源: 题型:
【题目】很多鲜花和水果的香味都来自酯的混合物.如图,图1是乙烯等为原料制取乙酸乙酯的过程(部分产物和反应条件已略去). 
请回答下列问题:
(1)B的结构简式为 .
(2)乙烯与水反应生成A的反应类型为 .
(3)A与C反应生成乙酸乙酯的化学方程式为 , 其反应类型为 .
(4)实验室可用图2装置制取乙酸乙酯. ①在试管a中加好相关试剂后,还需要加入2﹣3块的碎瓷片,其作用是 .
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯在该溶液的(填“上”或“下”)层,用分液的方法分离出该产品所需的主要仪器是 . 试管b中的导管口应在液面上方而不伸入到液面以下,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与 Y同族,Z 与X 形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. Na2O2、NaClO中所含化学键类型完全相同
B. 只有活泼金属与活泼非金属元素之间才能形成离子键
C. D2O和T2O含有同种元素
D. 氯气与NaOH反应的过程中,同时又离子键、极性键和非极性键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )
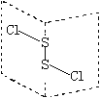
A.S2Cl2的结构中各原子均达到8电子的稳定结构
B.S2Cl2为含有极性键和非极性键的共价化合物
C.若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.已知A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是电子层数的3倍,C+和D3+离子的电子层结构相同,B与E属于同一主族.请回答下列问题:
(1)E在元素周期表中的位置是________
(2)上述元素形成的简单离子中,半径最小的是________(填离子符号).
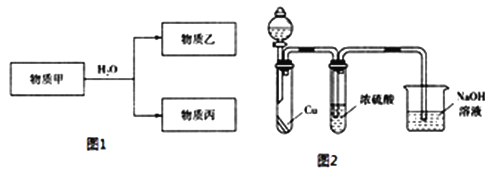
(3)由上述元素中的一种或几种组成的物质甲可以发生如图1反应:
①若乙具有漂白性,则乙的电子式为________.
②若丙的水溶液是强碱性溶液,则甲为______________(填化学式).
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为________;用电离方程式表示丙既能溶于强酸、又能溶于强碱的原因________.
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确.用如图2装置进行实验时,分液漏斗中应加入________(填试剂名称).实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
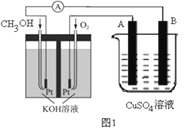
①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
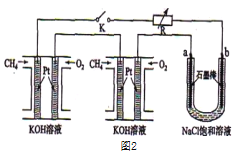
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____L(标准状况)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。
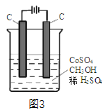
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: 
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com