
【题目】三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷的说法正确的是( )
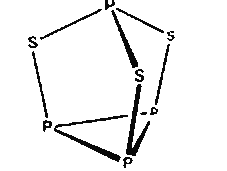
A. 该物质中磷元素的化合价为+3
B. 22 g P4S3含硫原子数目约为1.806×1023
C. 该物质分子结构中S、P最外层电子数均不为8
D. 该物质分子中全是极性共价键
科目:高中化学 来源: 题型:
【题目】随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 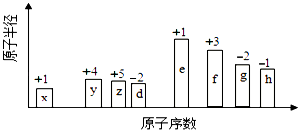
根据判断出的元素回答问题:
(1)f 在元素周期表的位置是;g的离子结构示意图为 .
(2)在z、d、e、f 四种元素中,其离子半径按由大到小的排列顺序为(用 化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性较强的是: .
(3)由x和z元素组成一种四原子共价化合物,写出其电子式 .
(4)由x、z、h三种元素构成的盐,其水溶液显酸性,用离子方程式解释其原因 .
(5)已知1mol e 的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
A. 密闭容器中氨气的体积分数不变
B. 1mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 2v(NH3)=v(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积和物质的量浓度都相等的盐酸和氢氧化钠溶液中投入足量的铝粉,放出的氢气在同温同压下的体积之比为
A. 1︰1 B. 1︰3 C. 3︰1 D. 1︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2(g)+6H2(g ) ![]() C2H4(g)+4H2O(g)。0.1Mpa时,按n(CO2):n(H2)=1:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图,下列叙述不正确的是( )
C2H4(g)+4H2O(g)。0.1Mpa时,按n(CO2):n(H2)=1:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图,下列叙述不正确的是( )

A. 该反应的ΔH<0
B. 曲线b代表H2O
C. N点和M点所处的状态c(H2)不一样
D. 其它条件不变,T1℃、0.2MPa下反应达平衡时c(H2)比M点大
【答案】C
【解析】温度升高,H2的浓度增大,平衡左移,故逆向吸热,正向放热,△H<0,则曲线a为CO2,根据方程式的比例关系,可知曲线b为H2O, 曲线c为C2H4;故A正确,B正确;C项:N点和M点均处于所处同一T1℃下,所处的状态的c(H2)是一样的;D项: 其它条件不变,T1℃、0.2 MPa相对0.1 MPa,增大了压强,体积减小,c(H2)增大,下反应达平衡时c(H2)比M点大,D项正确。
【题型】单选题
【结束】
12
【题目】据报导,我国已研制出“可充室温钠-二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠-四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是( )
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是( )
A. 放电时钠金属片发生氧化反应
B. 充电时碳纳米管接直流电源的正极
C. 放电时每消耗3mol CO2,转移12mol电子
D. 充电时的阳极反应为C+2Na2CO3—4e-===3CO2↑+4Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵. 已知盐的热分解温度:NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3>850℃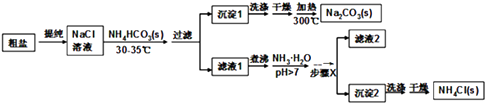
(1)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3 , 其加入的顺序合理的是 A.①③④②B.①②④③C.③②④①D.①②③④
过滤中用到玻璃棒的作用是;
(2)如何判断粗盐中SO42﹣是否已除尽?;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是;
(4)写出沉淀1受热分解的化学方程式;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是;步骤X包括的操作有;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液.从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL.则该样品中氯化铵的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com