
【题目】如表是a~m九种元素在周期表中的位置,请回答下列问题:
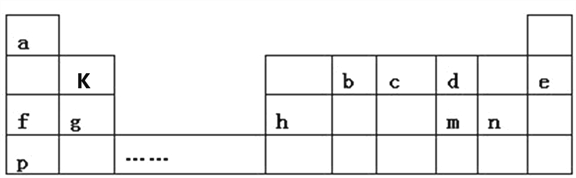
(1)m的阴离子结构示意图为____________。
(2)b的最高价氧化物的电子式为____________;用电子式表示f2 d2的形成过程_______________________。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___________(用离子符号填写)。
(4)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为__________(填化学式)。
(5)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为___________。
(6)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为__________。
(7)k的氧化物与氢氧化钠溶液反应的离子方程式为________________________。
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。

①丁属于_____________(选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式_____________。
【答案】 
![]()
![]() Cl->O2->Mg2+ KOH>NaOH>Mg(OH)2 KOH+HClO4=KClO4+H2O HNO3 + NH3 = NH4NO3 BeO+2OH-=BeO22-+H2O 离子化合物 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Cl->O2->Mg2+ KOH>NaOH>Mg(OH)2 KOH+HClO4=KClO4+H2O HNO3 + NH3 = NH4NO3 BeO+2OH-=BeO22-+H2O 离子化合物 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】根据a~m九种元素在周期表中的位置可判断,它们分别是H、C、N、O、Ne、Na、Mg、Al、S,K是Be,p是K,n是Cl。则
(1)硫离子结构示意图为 。(2)b的最高价氧化物是二氧化碳,电子式为
。(2)b的最高价氧化物是二氧化碳,电子式为![]() ;过氧化钠的形成过程可表示为
;过氧化钠的形成过程可表示为![]() 。(3)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数 增大而减小,则d、g、n形成的简单离子的半径由大到小的顺序为Cl->O2->Mg2+。(4)金属性越强,最高价氧化物水化物的碱性越强,则f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为KOH>NaOH>Mg(OH)2。(5)p和n两种元素最高价氧化物的水化物分别是氢氧化钾和高氯酸,相互反应的化学反应方程式为KOH+HClO4=KClO4+H2O。(6)c的氢化物氨气和c的最高价氧化物对应水化物硝酸之间反应的化学方程式为HNO3+NH3=NH4NO3。(7)k的氧化物与氧化铝的性质相似,与氢氧化钠溶液反应的离子方程式为BeO+2OH-=BeO22-+H2O。(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒,则甲是水,与金属钠反应生成氢氧化钠和氢气,铝与乙反应生成丙,则乙是氢氧化钠,丙是氢气,丁是偏铝酸钠。①偏铝酸钠含有离子键,属于离子化合物;②h单质与乙反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
。(3)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数 增大而减小,则d、g、n形成的简单离子的半径由大到小的顺序为Cl->O2->Mg2+。(4)金属性越强,最高价氧化物水化物的碱性越强,则f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为KOH>NaOH>Mg(OH)2。(5)p和n两种元素最高价氧化物的水化物分别是氢氧化钾和高氯酸,相互反应的化学反应方程式为KOH+HClO4=KClO4+H2O。(6)c的氢化物氨气和c的最高价氧化物对应水化物硝酸之间反应的化学方程式为HNO3+NH3=NH4NO3。(7)k的氧化物与氧化铝的性质相似,与氢氧化钠溶液反应的离子方程式为BeO+2OH-=BeO22-+H2O。(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒,则甲是水,与金属钠反应生成氢氧化钠和氢气,铝与乙反应生成丙,则乙是氢氧化钠,丙是氢气,丁是偏铝酸钠。①偏铝酸钠含有离子键,属于离子化合物;②h单质与乙反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
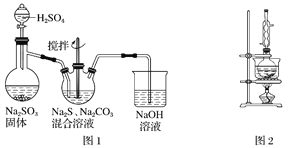
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是________________________。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除生成Na2S2O3外,还有________(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:_______________________________________________________________________。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加________作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有________。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤如下,请填写实验操作。
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示组装所需仪器,向冷凝管中通入冷却水,水浴加热;
③待________________时,停止加热,将烧瓶取下;
④____________________________________________________________________;
⑤____________________________________________________________________;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应中的能量变化,表述正确的是( )
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.酸碱中和反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:

已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
温度(℃) | 0 | 20 | 47 |
溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为 _________[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH![]() Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。

已知: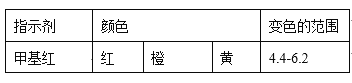
①当滴定到终点时,共需消耗NaOH溶液___mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案(图1和图2)进行实验探究:

(1)根据方案一装置(图1)回答以下问题:
Ⅰ.写出装置①发生的离子方程式:____________________________;
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与图3吻合的是______;(填字母代号)
Ⅲ.装置③中的现象是______。
(2)根据方案二装置(图2)回答以下问题:
Ⅰ.B装置中X是______,其作用为______;
Ⅱ.能说明碳元素和硅元素非金属性强弱的实验现象是________________;
Ⅲ.若没有装置B,则会产生的影响是_____________________。
(3)实验结论:图1为___________________________;图2为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )

A. 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42﹣
B. 肯定不含的阳离子是Mg2+、Fe3+
C. 要确定该溶液是否含有Na+,必须做焰色反应实验,看焰色是否为黄色
D. 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42﹣)=2:3:1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
A.只有AgBr沉淀生成
B.AgCl和AgBr沉淀等量生成
C.AgCl沉淀少于AgBr沉淀
D.AgCl沉淀多于AgBr沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com