
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
��1��ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼������ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
�������(mL��(��״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ���ʱ��η�Ӧ�������______min����0��1��1��2��2��3��3��4��4��5����ԭ����____________��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����__________(��Һ������䣩��
��2����һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���__________��
A������ˮ B��KCl��Һ C��KNO3��Һ D��CuSO4��Һ
��3����һ���¶��£���һ����������ͨ�����Ϊ2 L���ܱ������У�ʹ�䷢����Ӧ���й�����X��Y��Z�����ʵ����ı仯��ͼ��ʾ��

���������й��ƶ���ȷ����________________��
A���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�3Z![]() 3X+2Y
3X+2Y
B��t0ʱ��X��Y��Z���������ٸı�
C��t0ʱ��Z��Ũ��Ϊ1.2 mol/L
D��t0ʱ��Ӧֹͣ����Ӧ����Ϊ0
��t0ʱ��Z��ת����Ϊ_____________��
����t0=2min����2min����Y��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ��________________��
���𰸡� 2��3 min ��÷�Ӧ�Ƿ��ȷ�Ӧ����ʱ�¶ȸ�������Ũ�Ƚϴ����Է�Ӧ���ʽϿ� 0.025mol/(Lmin�� CD AB 60% 0.3 mol/(Lmin��
����������1�������ݱ������ݿ�֪0��1��1��2��2��3��3��4��4��5 minʱ������������������ֱ��ǣ�mL��100��140��224��112��44�����Է�Ӧ�������2��3min���������ڸ÷�Ӧ�Ƿ��ȷ�Ӧ����ʱ�¶ȸ�������Ũ�Ƚϴ����Է�Ӧ���ʽϿ�����3��4����ʱ�������������112mL�����ʵ�����0.005mol��������������0.01mol��Ũ����0.01mol��0.4L��0.025mol/L�������������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����Ϊ0.025mol/L��1min��0.025mol/(Lmin������2��A����������ˮϡ�����ᣬ������Ũ�Ƚ��ͣ���Ӧ���ʼ�С��A��ȷ��B������KCl��Һϡ�����ᣬ������Ũ�Ƚ��ͣ���Ӧ���ʼ�С��B��ȷ��C������KNO3��Һ����������Һ�����������ǿ�����ԣ��������Ӧ�ò���������C����D������CuSO4��Һ��п�û���ͭ������ͭпԭ��أ��ӿ췴Ӧ���ʣ�D����ѡCD����3����A��t0ʱ��Z�����ʵ���������3.0mol��1.2mol��1.8mol��X������1.8mol��Y������1.2mol�����Ը��ݱ仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪�÷�Ӧ�Ļ�ѧ����ʽ�ǣ�3Z![]() 3X+2Y��A��ȷ��B��t0ʱ��Ӧ�ﵽƽ��״̬��X��Y��Z���������ٸı���B��ȷ��C��t0ʱ��Z��Ũ��Ϊ1.2mol��2L��0.6 mol/L��C����D��t0ʱ��Ӧ�ﵽƽ��״̬����Ӧû��ֹͣ��D����ѡAB����t0ʱ��Z��ת����Ϊ1.8mol/3.0mol��100%��60%������t0=2min����2min����Y��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ
3X+2Y��A��ȷ��B��t0ʱ��Ӧ�ﵽƽ��״̬��X��Y��Z���������ٸı���B��ȷ��C��t0ʱ��Z��Ũ��Ϊ1.2mol��2L��0.6 mol/L��C����D��t0ʱ��Ӧ�ﵽƽ��״̬����Ӧû��ֹͣ��D����ѡAB����t0ʱ��Z��ת����Ϊ1.8mol/3.0mol��100%��60%������t0=2min����2min����Y��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ![]() ��0.3 mol/(Lmin����
��0.3 mol/(Lmin����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���ɫ��Ӧʵ�飬����ɫ�ܲ����۲쵽�������ɫ���ǣ�������
A.KCl
B.CuCl2
C.CaCl2
D.NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ��������У���������Щ���������ٷ����仯ʱ��������ӦA(g)��2B(g)![]() C(g)��D(g)�Ѵﵽƽ��״̬
C(g)��D(g)�Ѵﵽƽ��״̬
�ٻ�������ѹǿ�� �ڻ��������ܶȡ� �� B�����ʵ���Ũ�ȡ� �� �������������ʵ��� �ݻ�������ƽ����Է��������� ��v(C)��v(D)�ı�ֵ�� ������������������������������ ����C��D�ķ�����֮��Ϊ1��1
A. �٢ڢۢܢݢޢߢ� B. �٢ۢܢ� C. �٢ڢۢܢݢ� D. �٢ۢܢݢ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С��Ϊ����֤Ԫ�طǽ����Եݱ���ɣ��������ͼ��ʾ������ʵ�鷽����ͼ1��ͼ2������ʵ��̽����

��1�����ݷ���һװ�ã�ͼ1���ش��������⣺
����д��װ�������������ӷ���ʽ��____________________________��
����������Ӧ�����е���Һ����CCl4�У����ֵ�������ͼ3�Ǻϵ���______��������ĸ���ţ�
����װ�����е�������______��
��2�����ݷ�����װ�ã�ͼ2���ش��������⣺
��Bװ����X��______��������Ϊ______��
������˵��̼Ԫ�غ�Ԫ�طǽ�����ǿ����ʵ��������________________��
����û��װ��B����������Ӱ����_____________________��
��3��ʵ����ۣ�ͼ1Ϊ___________________________��ͼ2Ϊ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ���л�����һ�������¿ɷ�������ת��,����E������ʽC10H12O2�����й���ζ��

��ش��������⣺
��1��F�ķ���ʽ______________��Ӧ�ٵķ�Ӧ����____________
��2��д����Ӧ�۵Ļ�ѧ����ʽ________________________________________________
��3������˵���У���ȷ����_________
A. B����������ԭ�ӿ��ܹ�ƽ�� B.���³�ѹ������B����̬
C.1molB�����4molH2�����ӳ� D.C��G��ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42�������ӣ��������Һ�м���ijŨ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ��ʾ�������йضԸ���Һ���жϲ���ȷ���ǣ�������

A. ����Һ�п϶����е�������H+��NH4+��Al3+��SO42��
B. �϶���������������Mg2+��Fe3+
C. Ҫȷ������Һ�Ƿ���Na+����������ɫ��Ӧʵ�飬����ɫ�Ƿ�Ϊ��ɫ
D. ����Һ�п϶����е����ӵ����ʵ���֮��Ϊn��H+����n��NH4+����n��Al3+����n��SO42����=2��3��1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ұ���в����漰�ķ�Ӧ�����ǣ� ��
A.������ԭ��Ӧ
B.�û���Ӧ
C.�ֽⷴӦ
D.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D���ɳ����Ķ����ڷǽ���Ԫ���γɵĵ��ʣ�������A�ǵ���ɫ��ĩ��B��D�����壬F��G��H����ɫ��Ӧ��Ϊ��ɫ��ˮ��Һ���Լ��ԣ�E��Ư���ԡ�����֮���ת����ϵ��ͼ��ʾ�����ֲ��P��Ӧ��������ȥ�����ش��������⣺
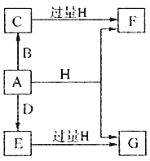
��1��A����Ԫ�������ڱ��е�λ��Ϊ______________��C�ĵ���ʽΪ_______________��
��2��A��H�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ__________________��
��3����A���ڷ��ڵ�G��Һ�п����Ƶû�����I��I��������Һ�в��ȶ��������ɵ����ʵ�����A��E��I����������������A��E�����ӷ���ʽΪ____________________��I����ǿ��ԭ�����ڷ�֯����ֽ��ҵ����Ϊ���ȼ�����I��Һ��ͨ�������ɷ�����Ӧ���μӷ�Ӧ��I�����������ʵ�����Ϊ1:4���÷�Ӧ�����ӷ���ʽΪ__________________��
��4������0.4molF��0.1molG�Ļ����Һ�м���������ᣬ��ȫ��Ӧ���ռ���aL����C����״������ȡ��Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g����a=____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������ܹ���һЩ±�ص��ʷ�����Ӧ����ǿ�ᡣij��ѧ��ȤС��ѡ������ʵ��װ�ã��ⶨ��ҵԭ����(��SO2��N2��O2) �е�SO2�ĺ�����
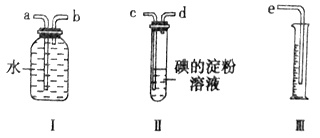
��1����ԭ����������������ʱ������װ����װ���ӵ�˳���ǣ�ԭ������____________(��a��b��c��d��e)��
��2��д��װ�����з�����Ӧ�����ӷ���ʽ_____________________ ����װ�â��г���___________________����ʱ������ֹͣͨ����
��3��������Һ��Ũ��Ϊ0.05mol/L�����Ϊ20mL���ռ�����N2��O2�����Ϊ297.6 mL(������Ϊ��״���µ����)��SO2���������Ϊ______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com