
【题目】已知二氧化硫能够与一些卤素单质发生反应生成强酸。某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2) 中的SO2的含量。
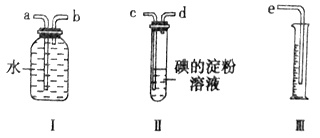
(1)若原料气以左向右流向时,上述装置组装连接的顺序是:原料气→____________(填a、b、c、d、e)。
(2)写出装置Ⅱ中发生反应的离子方程式_____________________ ;当装置Ⅱ中出现___________________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05mol/L、体积为20mL,收集到的N2与O2的体积为297.6 mL(己折算为标准状况下的体积),SO2的体积分数为______________。
【答案】 c→d→b→a→e SO2+I2+2H2O=4H++SO42-+2I- 蓝色褪去 7%
【解析】(1)原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4,吸收二氧化硫气体,通过装置Ⅰ、Ⅲ排水量气测定氧气和氮气的体积,因此连接装置接口顺序为:c→d→b→a→e;(2)装置Ⅱ是吸收二氧化硫气体,碘的淀粉溶液是蓝色,反应的离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,当蓝色褪去,说明碘单质全部反应,应停止通气,否则二氧化硫吸收不完全,造成误差;(3)反应方程式SO2+I2+2H2O=4H++SO42-+2I-,由条件知n(SO2)=n(I2)=0.05 mol/L×0.02 L=0.001 mol,即22.4 mL,所以工业原料气总体积为297.6 mL+22.4 mL=320 mL,因此SO2的体积分数=22.4mL/320mL×100%=7%。


科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是____________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是__________。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。

①则下列有关推断正确的是________________。
A.该反应的化学方程式是:3Z![]() 3X+2Y
3X+2Y
B.t0时,X、Y、Z的质量不再改变
C.t0时,Z的浓度为1.2 mol/L
D.t0时反应停止,反应速率为0
②t0时,Z的转化率为_____________。
③若t0=2min,则2min内用Y的浓度变化表示的反应速率为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。
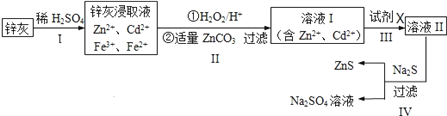
(1)为提高锌灰的浸取率,可采用的方法是____________(填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是_______________(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是_________________。
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为_______________________________;
(5)若步骤Ⅱ加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)元素名称:A__________,B____________,C_____________。
(2)D元素位于周期表中__________周期_________族,它的最高价氧化物对应的水化物的化学式是____________________。
(3)写出AB2与C2B2反应的化学方程式:____________________。
(4)写出D元素的最高价氧化物的水合物的浓溶液与A单质共热反应的化学方程式_________________。若要设计实验验证该反应产物,则验证的产物顺序是_____________(填写产物的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为 11℃,可用于处理含硫废水。某小组在实验室中探究 ClO2 与 Na2S 的反应。回答下列问题:
(1)ClO2 的制备
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
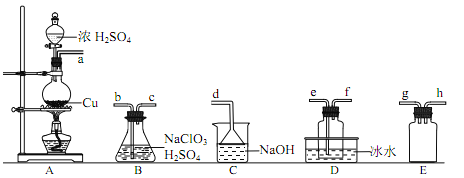
①装置 A 中反应的化学方程式为____________。
②欲收集干燥的 ClO2,选择上图中的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)
③装置 D 的作用是__________________。
(2)ClO2 与 Na2S 的反应
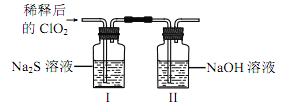
将上述收集到的 ClO2 用 N2 稀释以增强其稳定性,并将适量的稀释后的 ClO2 通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
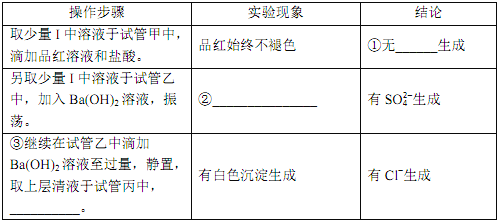
①___________。②___________。③___________。
④ClO2 与 Na2S 反应的离子方程式为____________。用于处理含硫废水时,ClO2 相对于Cl2 的优点是____________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
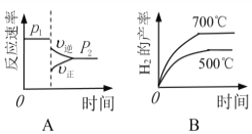
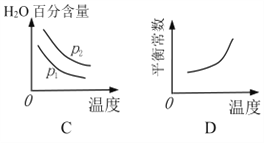
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
由表中数据判断:p1 ______ p2(填“>”、“<”或“=”)
下列图像正确的是_________。
(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向_____________(填“正反应”、“逆反应”)方向移动;当重新平衡后,CO2浓度_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com