
【题目】下列各组物质间的反应不属于离子反应的是( )
A.盐酸+NaOH溶液B.CaCl2溶液+AgNO3溶液
C.Fe+CuSO4溶液D.C+O2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知二氧化硫能够与一些卤素单质发生反应生成强酸。某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2) 中的SO2的含量。
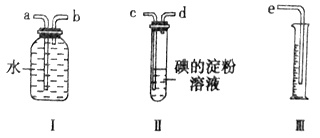
(1)若原料气以左向右流向时,上述装置组装连接的顺序是:原料气→____________(填a、b、c、d、e)。
(2)写出装置Ⅱ中发生反应的离子方程式_____________________ ;当装置Ⅱ中出现___________________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05mol/L、体积为20mL,收集到的N2与O2的体积为297.6 mL(己折算为标准状况下的体积),SO2的体积分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氢气完全加成后,不可能生成2,2,3﹣三甲基戊烷的烃是( )
A.(CH3)3C﹣CH=CH2
B.CH2=C(CH2CH3)C(CH3)3
C.HC≡CCH(CH3)C(CH3)3
D.(CH3)3CC(CH3)=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计一个简单的一次性完成实验的装置图,目的是验证醋酸溶液,二氧化碳水溶液、苯酚溶液的酸性强弱顺序. 
(1)利用如图所示的仪器可以组装实验装置,则仪器的连接顺序为:接接接(填字母)
(2)写出装置Ⅰ和Ⅱ中的实验现象:
Ⅰ中
Ⅱ中 .
(3)写出装置Ⅰ和装置Ⅱ中发生反应的方程式
Ⅰ中
Ⅱ中 .
(4)由强到弱排序三者的酸性顺序>>(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g)![]() 4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A. v(A)=1.0 mol·L-1·min-1 B. v(B)=1.8 mol·L-1·min-1
C. v(D)=0.2 mol·L-1·s-1 D. v(C)=0.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按已知的原子结构规律,27号元素在周期表中的位置是____________,其价电子的轨道排布图为_____________________________。
(2)若en代表乙二胺(![]() ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为____________。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为____________。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①Cl-Be-Cl ____________。
② ![]() ____________。
____________。
③![]() ___________。
___________。
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
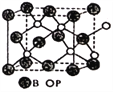
①画出三溴化硼和三溴化磷的空间结构式(必须体现出分子立体结构)。
三溴化硼____________________。
三溴化磷____________________。
②在BP晶胞中B的堆积方式为____________。
③计算当晶胞参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如右图所示,图中只有Hg(OH)2为难溶物[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=lgc(Cl-)]。

(1)正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是_______。少量Hg(NO3)2溶于0.001mol/L盐酸后得到无色透明溶液,其中汞元素的主要存在形态是_______。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是_______(用离子方程式表示),为了防止出现浑浊,可采取的措施是_______。
(3)HgCl2是一种弱电解质,结合图像写出其电离方程式为_______。
(4)当溶液PCl保持在4,pH由7改变为3时,可使Hg(OH)2转化为HgCl2,请写出对应的离子方程式_______。
(5)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水,反应的离子方程式为_______。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。己知Ksp(HgS)=1.6×10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com