
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
【答案】C
【解析】CuCl2、Na2S水解促进水电离, b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离没有作用,水的电离程度最小的为b点,故A错误;根据物料守恒Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)= c(Na+),故B错误;b点是CuCl2与Na2S溶液恰好完全反应的点,c(Cu2+)= c(S2-),根据b点数据,c(Cu2+)=![]() mol/L,该温度下Ksp(CuS)=4×10-36 mol2/L2,故C正确;Ksp(ZnS)=3×10-25 mol2/L2大于Ksp(CuS),所以向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Cu2+先沉淀,故D错误。
mol/L,该温度下Ksp(CuS)=4×10-36 mol2/L2,故C正确;Ksp(ZnS)=3×10-25 mol2/L2大于Ksp(CuS),所以向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Cu2+先沉淀,故D错误。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)元素名称:A__________,B____________,C_____________。
(2)D元素位于周期表中__________周期_________族,它的最高价氧化物对应的水化物的化学式是____________________。
(3)写出AB2与C2B2反应的化学方程式:____________________。
(4)写出D元素的最高价氧化物的水合物的浓溶液与A单质共热反应的化学方程式_________________。若要设计实验验证该反应产物,则验证的产物顺序是_____________(填写产物的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1是在两种投料比[c(CO2)/c(H2+CO)]分别为1:4 和1:6 时,CO2平衡转化率随温度变化的曲线,图2 是生成的甲醇/过氧化氢燃料电池的工作原理示意图:
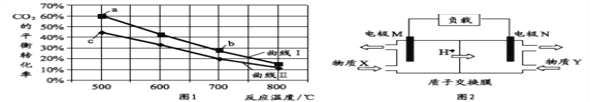
下列有关说法正确的是( )
A. 图2中电极M上发生还原反应
B. 图2中电极N的反应式:H2O2+2e+2H+=2H2O
C. 图1中b点对应的平衡常数K值大于c点
D. 图1中a点对应的H2的转化率等于30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O
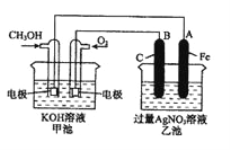
(1)乙池是__________装置。
(2)通入CH3OH的电极名称是______________________
(3)通入O2的电极的电极反应式是__________________________。若甲池用熔融碳酸盐为电解质,则通入O2的电极的电极反应式为___________________。
(4)乙池中反应的化学方程式为_______________________________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_________mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物的研究在无机化学的发展中占有独特的地位。
(1)硼元素有10B和11B两种天然稳定同位素,在基态11B原子中,价电子中存在______对自旋方向相反的电子。第一电离能介于B与N之间的第二周期元素有______种。
(2)目前已制得二十多种硼氢化合物,如乙硼烷B2H6、丁硼烷B4H10等在能源方面前景可期。
①NH3能通过配位键与硼元素的某种氢化物作用得到化合物M, M是一种新的储氢材料,加热M 会缓慢释放出H2,并转化为化合物N, M、N分别是乙烷、乙烯的等电子体。M的结构式为______须标出配位键),氮原子在M、N分子中的杂化方式分别为_________。
②B2H6可作火箭燃料,将B2H6气体通入H2O中的反应为B2H6+6H20=2H3BO3+6H2↑,据此可判断反应中所涉及元素的电负性从小到顺序为_________。
③以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,可将竣基直接还原成醇。
CH3C00H ![]() CH3CH2OH
CH3CH2OH 
上图中乙酸分子键角1>键角2,其原因为_____________。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,如图1所示。

①图II是磷化硼沿Z轴的投影图,请在图II中圆球上涂“![]() ”和画“×”分别表明B与P的相对位置_____________。
”和画“×”分别表明B与P的相对位置_____________。
②已知晶胞边长为apm,则磷化硼的密度是______g/cm3(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
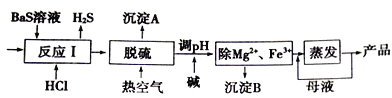
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在规定范围内使用食品添加剂,一般认为对人体健康无害,如果违反规定,均会损害人体健康.下列物质可用作食品防腐剂的是( )
A.甲醛
B.维生素E
C.柠檬酸
D.苯甲酸及其钠盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com