
����Ŀ��A��B��D���ɳ����Ķ����ڷǽ���Ԫ���γɵĵ��ʣ�������A�ǵ���ɫ��ĩ��B��D�����壬F��G��H����ɫ��Ӧ��Ϊ��ɫ��ˮ��Һ���Լ��ԣ�E��Ư���ԡ�����֮���ת����ϵ��ͼ��ʾ�����ֲ��P��Ӧ��������ȥ�����ش��������⣺
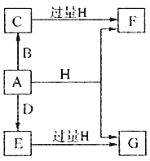
��1��A����Ԫ�������ڱ��е�λ��Ϊ______________��C�ĵ���ʽΪ_______________��
��2��A��H�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ__________________��
��3����A���ڷ��ڵ�G��Һ�п����Ƶû�����I��I��������Һ�в��ȶ��������ɵ����ʵ�����A��E��I����������������A��E�����ӷ���ʽΪ____________________��I����ǿ��ԭ�����ڷ�֯����ֽ��ҵ����Ϊ���ȼ�����I��Һ��ͨ�������ɷ�����Ӧ���μӷ�Ӧ��I�����������ʵ�����Ϊ1:4���÷�Ӧ�����ӷ���ʽΪ__________________��
��4������0.4molF��0.1molG�Ļ����Һ�м���������ᣬ��ȫ��Ӧ���ռ���aL����C����״������ȡ��Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g����a=____________________��
���𰸡� �������� ����A�� ![]() 3S + 6NaOH
3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O 2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O 2H+ + S2O32- ![]() S��+ SO2��+H2O 4Cl2 +S2O32-+ 5H2O
S��+ SO2��+H2O 4Cl2 +S2O32-+ 5H2O![]() 8Cl- + 2SO42- + 10H+ 2.24
8Cl- + 2SO42- + 10H+ 2.24
��������������A�ǵ���ɫ��ĩ����Ϊ���ʣ���A����B��D�����壬A��D����E��E��Ư���ԣ�˵��EΪSO2��D��O2����B��H2��CΪH2S��F��G��H����ɫ��Ӧ��Ϊ��ɫ��F��G��H�о�������Ԫ�أ�ˮ��Һ���Լ��ԣ�SO2��H2S������H��Ӧ��HΪNaOH����FΪNa2S��GΪNa2SO3����1��A�����ʣ�λ�ڵ������ڢ�AԪ�أ�CΪH2S�����ڹ��ۻ���������ʽΪ![]() ����2���������ȵ�����������Һ�����绯��Ӧ���������ƺ��������ƣ�����Ӧ����ʽΪ��3S + 6NaOH
����2���������ȵ�����������Һ�����绯��Ӧ���������ƺ��������ƣ�����Ӧ����ʽΪ��3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O����3��S�ͷ���Na2SO3�õ�������Na2S2O3��Na2S2O3����������������S��SO2�������ӷ�Ӧ����ʽΪ��2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O����3��S�ͷ���Na2SO3�õ�������Na2S2O3��Na2S2O3����������������S��SO2�������ӷ�Ӧ����ʽΪ��2H+ + S2O32- ![]() S��+ SO2��+H2O����������ǿ�����ԣ��ܰ�S2O32��������SO42������������ԭ��Cl����Na2SO3�����������ʵ���֮��Ϊ1��4�������ߵ�ϵ��Ϊ1��4��S2O32����4Cl2��2SO42����8Cl�������ݻ�ѧ��Ӧ����ʽԭ�Ӹ����غ㣬��Ӧǰ��5��O����ȱ��5molH2O������������Ӧ��10H���������ӷ�Ӧ����ʽΪ4Cl2��S2O32����5H2O=8Cl����2SO42����10H������4����Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g�����ݷ�Ӧ2Fe3����S2��=2Fe2����S�����÷�Ӧ�����ĵ�Na2SΪ0.1mol��Na2S��Na2SO3�Ļ����Һ�м���������ᣬ������Ӧ��2S2����SO32����6H��=3S����3H2O������Na2SO3 0.1mol��ʣ���Na2S 0.1mol�����ᷴӦ�ų�H2S���ų�H2S�����ʵ���Ϊ0.1mol����״���µ����Ϊ2.24L��
S��+ SO2��+H2O����������ǿ�����ԣ��ܰ�S2O32��������SO42������������ԭ��Cl����Na2SO3�����������ʵ���֮��Ϊ1��4�������ߵ�ϵ��Ϊ1��4��S2O32����4Cl2��2SO42����8Cl�������ݻ�ѧ��Ӧ����ʽԭ�Ӹ����غ㣬��Ӧǰ��5��O����ȱ��5molH2O������������Ӧ��10H���������ӷ�Ӧ����ʽΪ4Cl2��S2O32����5H2O=8Cl����2SO42����10H������4����Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g�����ݷ�Ӧ2Fe3����S2��=2Fe2����S�����÷�Ӧ�����ĵ�Na2SΪ0.1mol��Na2S��Na2SO3�Ļ����Һ�м���������ᣬ������Ӧ��2S2����SO32����6H��=3S����3H2O������Na2SO3 0.1mol��ʣ���Na2S 0.1mol�����ᷴӦ�ų�H2S���ų�H2S�����ʵ���Ϊ0.1mol����״���µ����Ϊ2.24L��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��R�Ƕ�����Ԫ�أ�ԭ��������������Xԭ�Ӻ�����������֮��Ϊ1��2��Yԭ�Ӻ�Zԭ�ӵĺ��������֮��Ϊ20��W��R��ͬ��������Ԫ�أ�Y���������R������������γ����꣮ ��ش��������⣺
��1��Ԫ��X�����������ĵ���ʽΪ��Ԫ��Z�����ӽṹʾ��ͼΪ ��
��2������X��Ԫ��Y������������Ӧˮ�����Ũ��Һ������Ӧ�Ļ�ѧ����ʽΪ �� Y��W���⻯��е�ߵ�����д��ѧʽ����ԭ���� ��
��3��Ԫ��W�����ڱ��е�λ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
��1��ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼������ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
�������(mL��(��״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ���ʱ��η�Ӧ�������______min����0��1��1��2��2��3��3��4��4��5����ԭ����____________��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����__________(��Һ������䣩��
��2����һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���__________��
A������ˮ B��KCl��Һ C��KNO3��Һ D��CuSO4��Һ
��3����һ���¶��£���һ����������ͨ�����Ϊ2 L���ܱ������У�ʹ�䷢����Ӧ���й�����X��Y��Z�����ʵ����ı仯��ͼ��ʾ��

���������й��ƶ���ȷ����________________��
A���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�3Z![]() 3X+2Y
3X+2Y
B��t0ʱ��X��Y��Z���������ٸı�
C��t0ʱ��Z��Ũ��Ϊ1.2 mol/L
D��t0ʱ��Ӧֹͣ����Ӧ����Ϊ0
��t0ʱ��Z��ת����Ϊ_____________��
����t0=2min����2min����Y��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ÿ����������ȵļӴ�����չ������ȼ�ϵ��������Ϊ�о����⡣��ͼ��ij��������Ƶ�Һ��ȼ�ϵ��ʾ��ͼ�������й���������ȷ����

A. �õ�ص��ŵ��Dz�������Ⱦ���壬��Һ��ȼ�ϱ���Я��
B. ����ڲ�ʹ�õ��������ӽ���Ĥ��OH-������Ĥ����
C. ��ȼ�ϵ�صĵ缫���ϲ��ö������̼���ϣ���ͼ����Ŀ��������Ӵ����������������
D. �õ����ͨ��N2H4�ĵ缫Ϊ�����������ĵ缫��ӦʽΪN2H4+4OH--4e-=N2��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ�Ȼ����Һ����������̨Ļ�������Ż���ԭ���ǣ�������
��Ļ�����Ż������
��Ļ������������
���Ȼ�立ֽ������������������¶�
���Ȼ�立ֽ��������������˿�����
A.�٢�
B.�ۢ�
C.�٢�
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù��IJ�˿պȡ��ɫ��Һ����ɫ����������ʱ�۲쵽��ɫ���棬����������ȷ���ǣ�������
A.ֻ����Na+B.һ����Na+��Ҳ�ɺ�K+
C.�Ⱥ�Na+�ֺ���K+D.���ܺ�Na+��K+��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��Q��R��Ϊǰ20��Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ۵Ĺ�ϵ��ͼ��ʾ������˵��������

A. Qλ�ڵ�������IA��
B. X��Y��Z����Ԫ����ɵĻ�����������λ��
C. �����Ӱ뾶��M->Q+>R2+
D. Z��M������������Ӧˮ�����Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п(ZnS)��һ����Ҫ�Ļ���ԭ�ϣ�������ˮ��������п�ķ���п����ȡ���乤����������ͼ��ʾ��
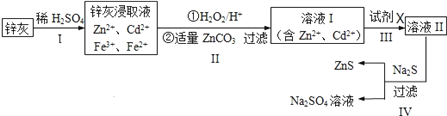
��1��Ϊ���п�ҵĽ�ȡ�ʣ��ɲ��õķ�����____________(�����)��
����ĥ �ڶ�ν�ȡ �������¶� �ܼ�ѹ �ݽ���
��2����������������е�������_______________(д��ѧʽ)��
��3��������пɵ�Cd���ʣ�Ϊ���������µ����ʣ��Լ�XӦΪ____________��
��4������������Ի���Na2SO4����ȡNa2S��
�ټ���ZnS�����Ƿ�ϴ�Ӹɾ��ķ�����_________________��
��Na2S���ɵ����ʵ�����Na2SO4��CH4�ڸ��¡�������������ȡ����ѧ��Ӧ����ʽΪ_______________________________��
��5�������������ZnCO3Ϊbmol�����������CdΪdmol,���õ�VL�����ʵ���Ũ��Ϊcmol/L��Na2SO4��Һ��������������п���к���пԪ�ص�����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϡ���������ʣ���C �ƣ���ˮ������Ӧ��ȡH2��һ�ֵͺ��ܣ���Ч�ʵ���H2�������÷���������¯����H2��ȼ��¯����CaO�������ɡ�����¯���漰���ķ�ӦΪ��
I.C��s��+H2O��g��![]() CO��g��+H2��g�� K1��
CO��g��+H2��g�� K1��
��.CO��g��+H2O��g��![]() CO2��g��+H2��g�� K2��
CO2��g��+H2��g�� K2��
��.CaO��s��+CO2��g��![]() CaCO3��s�� K3��
CaCO3��s�� K3��
��1���ù�����H2�ܷ�Ӧ�ɱ�ʾΪC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)���䷴Ӧ��ƽ�ⳣ��K=_______________����K1��K2��K3�Ĵ���ʽ��ʾ������2L���ܱ������м���һ������C(s)��H2O(g)��CaO(s)��������˵����Ӧ�ﵽƽ��״̬����__________��
CaCO3(s)+2H2(g)���䷴Ӧ��ƽ�ⳣ��K=_______________����K1��K2��K3�Ĵ���ʽ��ʾ������2L���ܱ������м���һ������C(s)��H2O(g)��CaO(s)��������˵����Ӧ�ﵽƽ��״̬����__________��
a�������ڻ������������� b��H2��H2O��g�������ʵ���֮�Ȳ��ٱ仯
c�����������ܶȲ��ٱ仯 d���γ� a mol H-H����ͬʱ���� 2 amol H-O��
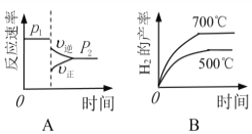
��2�����ڷ�Ӧ������ͬ�¶Ⱥ�ѹǿ��H2����Ӱ�����±���
ѹǿ �¶� | p1/Mpa | p2/Mpa |
500�� | 45.6% | 51.3% |
700�� | 67.8% | 71.6% |
�ɱ��������жϣ�p1 ______ p2���������������������
����ͼ����ȷ����_________��
��3����֪��Ӧ������H= ��41.1 kJ/mol�� C��O��O��H��H��H�ļ��ֱܷ�Ϊ803kJ/mol��464 kJ/mol��436 kJ/mol���� CO��̼�����ļ���Ϊ___________ kJ/mol��
��4�����ڷ�Ӧ������ƽ��ʱ�ٳ���CO2��ʹ��Ũ������ԭ����2������ƽ����_____________����������Ӧ�������淴Ӧ���������ƶ���������ƽ���CO2Ũ��_________�����������������С����������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com