
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:

已知:醛或酮与锌汞齐(Zn-Hg)在浓盐酸条件下发生如下反应,称为Clemmensen反应

(1)请举出工业上获得原料A的来源:_________________________________________。
(2)B催化氢化得Z(C10H12O3),写出Z在一定条件下聚合反应的化学方程式:___________。
(3)请写出![]() 的化学方程式:________________,D中官能团名称是____________。
的化学方程式:________________,D中官能团名称是____________。
(4)Clemmensen反应的可能机理是:锌汞齐在浓盐酸的介质中形成原电池,其中锌为__________(填“正极”或“负极”),请写出D在汞电极上生成E的电极反应方程式:____________________。
(5)![]() 的反应类型为_____________。
的反应类型为_____________。
(6)I分子中最多有_______个原子共平面。与I属于同种类型物质且苯环上有两个取代基的同分异构体有_____________种。
(7)符合下列条件的J的一种同分异构体结构简式为______________________。
①属于芳香族化合物,②不能与金属钠反应,③有3种不同化学环境的氢原子。
(8)已知: (R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以
(R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以 、
、![]() 为原料制备
为原料制备 的合成路线图。(合成路线流程图示例见本题题干)。
的合成路线图。(合成路线流程图示例见本题题干)。
 _______________
_______________
【答案】煤的干馏(煤焦油)或石油的催化重整 n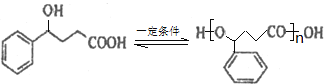 +(n-1)H2O
+(n-1)H2O 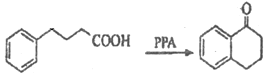 +H2O 羰基 负极
+H2O 羰基 负极  +4H++4e-
+4H++4e-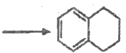 +H2O 氧化反应 21 14
+H2O 氧化反应 21 14 
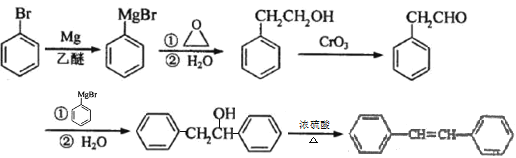
【解析】
由A、B的结构可知,A与![]() 发生反应生成B为
发生反应生成B为 ,B与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成C,由已知反应及B的结构可知C的结构为
,B与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成C,由已知反应及B的结构可知C的结构为 ![]() ,C发生反应生成D为
,C发生反应生成D为  ,D与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成E为
,D与锌汞齐(Zn-Hg)在浓盐酸条件下发生反应生成E为![]() ,E发生去氢反应生成F为
,E发生去氢反应生成F为 ![]() ,F发生卤代反应生成G为
,F发生卤代反应生成G为 ,G与Mg在乙醚存在的条件下生成H为
,G与Mg在乙醚存在的条件下生成H为 ,H与环氧乙烷反应后再水解生成I为
,H与环氧乙烷反应后再水解生成I为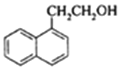 ,H被CrO3氧化得到J为
,H被CrO3氧化得到J为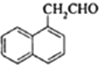 , 据此解答。
, 据此解答。
(1)A为苯,工业上用煤的干馏(煤焦油)或石油的催化重整获得苯。
故答案为:煤的干馏(煤焦油)或石油的催化重整;
(2)B催化氢化得Z,结合Z的分子式可知,该反应为羰基与氢气发生加成反应,故Z为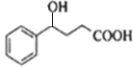 ,Z通过酯化反应进行的缩聚反应生成高聚物,该反应方程式为:
,Z通过酯化反应进行的缩聚反应生成高聚物,该反应方程式为: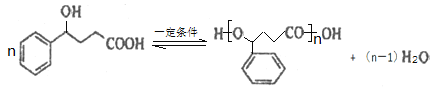 。
。
故答案为: ;
;
(3)C发生反应生成D为  ,化学方程式为:
,化学方程式为: ;由D的结构简式,可知D中官能团名称是羰基。
;由D的结构简式,可知D中官能团名称是羰基。
故答案为: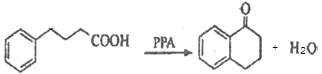 ;羰基;
;羰基;
(4)锌汞齐在浓盐酸的介质中,形成原电池,锌比汞活泼,则锌为负极,汞电极为正极,正极发生还原反应,所以 在汞电极上生成
在汞电极上生成![]() 的电极反应方程式:
的电极反应方程式: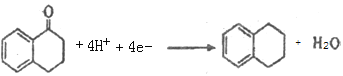 。
。
故答案为:负极;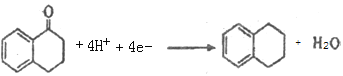 ;
;
(5)E为![]() ,E发生去氢反应生成F为
,E发生去氢反应生成F为 ![]() ,去氢属于氧化反应。
,去氢属于氧化反应。
故答案为:氧化反应;
(6)I为 ,分子中苯环共平面,苯环上的碳原子以及与苯环相连的碳原子、氢原子一定在同一平面上,有18个原子;由于碳碳单键可以旋转,所以与苯环相连的碳原子相连的两个氢原子和一个碳原子(-CH2OH中的C)最多有一个原子在这个平面上,同理羟基上的O、H原子也可能在此平面上,所以最多有18+1+2=21个原子共平面。I属于芳香醇,与I属于同种类型物质且苯环上有两个取代基,则羟基不能连到苯环上,两个取代基为-CH3和-CH2OH,符合条件的同分异构体种数的根据萘环的对称性,萘环上有如图
,分子中苯环共平面,苯环上的碳原子以及与苯环相连的碳原子、氢原子一定在同一平面上,有18个原子;由于碳碳单键可以旋转,所以与苯环相连的碳原子相连的两个氢原子和一个碳原子(-CH2OH中的C)最多有一个原子在这个平面上,同理羟基上的O、H原子也可能在此平面上,所以最多有18+1+2=21个原子共平面。I属于芳香醇,与I属于同种类型物质且苯环上有两个取代基,则羟基不能连到苯环上,两个取代基为-CH3和-CH2OH,符合条件的同分异构体种数的根据萘环的对称性,萘环上有如图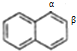 中
中![]() 两种类型的氢原子,采用定一移二的方法,若-CH3在
两种类型的氢原子,采用定一移二的方法,若-CH3在![]() 位,-CH2OH可以在其它位置,共有7种结构;若-CH3在
位,-CH2OH可以在其它位置,共有7种结构;若-CH3在![]() 位,-CH2OH也在
位,-CH2OH也在![]() 位,共有3种结构;另外若-CH2OH 在
位,共有3种结构;另外若-CH2OH 在![]() 位,-CH3可以在其它位置,共有7种结构,但其中有3种与前面的重复,除此之外还有4种结构,所以符合条件的同分异构体有7+3+4=14种;
位,-CH3可以在其它位置,共有7种结构,但其中有3种与前面的重复,除此之外还有4种结构,所以符合条件的同分异构体有7+3+4=14种;
故答案为:21;14;
(7)J为 ,J的同分异构体中,①属于芳香族化合物说明含有苯环,②不能与金属钠反应说明不含羟基,③有3种不同化学环境的氢原子,由J的结构可知,分子中H原子数目很多,故该同分异构体为对称结构,不饱和度为8,可以是两个独立的苯环,另外的O原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为
,J的同分异构体中,①属于芳香族化合物说明含有苯环,②不能与金属钠反应说明不含羟基,③有3种不同化学环境的氢原子,由J的结构可知,分子中H原子数目很多,故该同分异构体为对称结构,不饱和度为8,可以是两个独立的苯环,另外的O原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为 。
。
故答案为: ;
;
(8)根据题干由G到J的转化条件,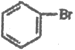 发生信息中的反应生成
发生信息中的反应生成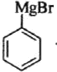 ,
, 与
与![]() 反应生成
反应生成 ,氧化后生成
,氧化后生成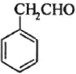 ,
, 与
与 反应转化为
反应转化为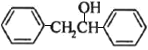 ,最后脱水得到
,最后脱水得到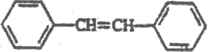 ,合成路线图为:
,合成路线图为:
 。
。
故答案为:


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② 2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

回答下列问题:
(1)B、D分子中的官能团名称分别是____、_____。
(2)写出下列反应的反应类型:①________,②__________,④_________。
(3)写出下列反应的化学方程式:
①__________;
②__________;
④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和 3molH2(g) | 1mol CH3OH (g)和 1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
请回答:
①a=_______________;
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___________。
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质检验是化学研究常用的方法之一。下列有关溶液成分的检验,结论不正确的是
A.若滴加酚酞溶液,溶液变红,原溶液不一定是碱溶液
B.若先滴加足量新制氯水,再滴加少量KSCN溶液,溶液变为血红色,则原溶液一定含有Fe2+
C.若滴加Na2CO3溶液,产生白色沉淀,则原溶液可能含有Ca2+
D.若滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原溶液中可能含CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
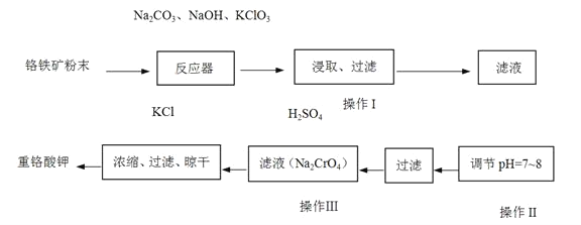
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备 Fe(OH)2。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂后应________(填“打开”或者“关闭”)止水夹,反应一会儿后应________(填“打开”或者“关闭”)止水夹。
II.某化学兴趣小组用下图装置制取并探究氯气的性质。[A装置中发生反应的化学方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2 + 5Cl2↑+ 8H2O ]

(1)A装置中a仪器的名称是_____________。
(2)实验室制氯气也可用MnO2与浓盐酸反应,化学方程式为:_____
(3)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,请用化学方程式表示其褪色原因__________。
(4)当氯气进入D装置后,可观察到溶液颜色变为____(填“红色”或“蓝色”),写出该反应的离子方程式为_________。
(5)E装置中反应的化学方程式为________。
(6)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_____L氯气。(KMnO4的摩尔质量为158 g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二,而云南钼的产量又居中国首位。钼及其合金在冶金、农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1:1,完成下列方程式:_____Mo+_____HF+_____HNO3=_____MoO2F2+_____MoOF4+_____NO2↑+__________
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②MoS2(s)+2O2(g)═Mo(s)+2SO2(g)△H2
③2MoS2(s)+7O2(g)═2MoO3(s)+4SO2(g)△H3
则ΔH3=_____(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_________mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理为以下所示化学方程式MoS2(s)+4H2(g)+2Na2CO3(s)═Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H
实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH_____0(填“>”或“<”);P2_____0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是_____选填编号)
A.V正(H2)=V逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达到平衡状态
D.容器内压强不变时,一定达到平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=_____(MPa)2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)元素A、B、C中,电负性最大的是____(填元素符号,下同),元素B、C、D第一电离能由大到小的顺序为________。
(2)与同族其它元素X形成的XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28′(填“>”“<”或“=”),原因是________。
(3)BC3-离子中B原子轨道的杂化类型为____________,BC3-离子的立体构型为________________。
(4)基态E原子的电子排布式为________;C、E形成的化合物EC5(其中E的化合价为+6)中σ键与π键数目之比为________;
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为_____g·cm-3(用NA表示阿伏加德罗常数)。
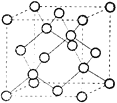
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com