
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)元素A、B、C中,电负性最大的是____(填元素符号,下同),元素B、C、D第一电离能由大到小的顺序为________。
(2)与同族其它元素X形成的XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28′(填“>”“<”或“=”),原因是________。
(3)BC3-离子中B原子轨道的杂化类型为____________,BC3-离子的立体构型为________________。
(4)基态E原子的电子排布式为________;C、E形成的化合物EC5(其中E的化合价为+6)中σ键与π键数目之比为________;
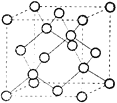
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为_____g·cm-3(用NA表示阿伏加德罗常数)。
【答案】O N>O>Al NH3分子间易形成氢键 < 孤电子对对成键电子对的排斥作用强于成键电子对之间的排斥作用 sp2 三角形 1s22s22p63s23p63d54s1(或[Ar] 3d54s1) 7:1 ![]() ×1030
×1030
【解析】
前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态,A为H元素;基态B原子s能级的电子总数比p能级的多1,核外电子排布为1s22s22p3,为N元素;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍,核外电子排布为1s22s22p4、1s22s22p63s23p63d54s1,则C为O元素,E为Cr元素;D形成简单离子的半径在同周期元素形成的简单离子中最小,则D为该周期中原子序数最大的金属元素,因此D为Al元素。据此分析解答。
根据上述分析,A为H元素,B为N元素,C为O元素,D为Al元素,E为Cr元素。
(1)元素的非金属性越强,电负性越大,元素H、N、O中,电负性最大的是O元素;同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,同一主族,从上到下,第一电离能逐渐减小,
元素N、O、Al的第一电离能由大到小的顺序为N>O>Al,故答案为:O;N>O>Al;
(2)NH3分子间易形成氢键,导致氨气易液化;NH3中中心原子N的价层电子对数为4,孤电子对数为1,其VSEPR模型为四面体构型,NH3分子中N原子采用sp3杂化,为三角锥结构,孤电子对对成键电子对的排斥作用强于成键电子对之间的排斥作用,使得氨气分子中键角小于109°28′,故答案为:NH3分子间易形成氢键;<;孤电子对对成键电子对的排斥作用强于成键电子对之间的排斥作用;
(3)NO3-离子中N原子的价层电子对数=σ键电子对数+孤电子对数=3+![]() =3,采用sp2杂化,立体构型为三角形,故答案为:sp2;三角形;
=3,采用sp2杂化,立体构型为三角形,故答案为:sp2;三角形;
(4) E为Cr元素,基态E原子的电子排布式为1s22s22p63s23p63d54s1(或[Ar] 3d54s1);C、E形成的化合物CrO5(其中E的化合价为+6),结构为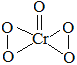 ,其中σ键与π键数目之比为7:1,故答案为:1s22s22p63s23p63d54s1(或[Ar] 3d54s1);7:1;
,其中σ键与π键数目之比为7:1,故答案为:1s22s22p63s23p63d54s1(或[Ar] 3d54s1);7:1;
(5)AlN晶胞中含有N或Al原子数为4,8×![]() +6×
+6×![]() =4,晶胞质量为
=4,晶胞质量为![]() g,因此晶胞的密度=
g,因此晶胞的密度= =
=![]() ×1030 g·cm-3,故答案为:
×1030 g·cm-3,故答案为:![]() ×1030。
×1030。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:

已知:醛或酮与锌汞齐(Zn-Hg)在浓盐酸条件下发生如下反应,称为Clemmensen反应

(1)请举出工业上获得原料A的来源:_________________________________________。
(2)B催化氢化得Z(C10H12O3),写出Z在一定条件下聚合反应的化学方程式:___________。
(3)请写出![]() 的化学方程式:________________,D中官能团名称是____________。
的化学方程式:________________,D中官能团名称是____________。
(4)Clemmensen反应的可能机理是:锌汞齐在浓盐酸的介质中形成原电池,其中锌为__________(填“正极”或“负极”),请写出D在汞电极上生成E的电极反应方程式:____________________。
(5)![]() 的反应类型为_____________。
的反应类型为_____________。
(6)I分子中最多有_______个原子共平面。与I属于同种类型物质且苯环上有两个取代基的同分异构体有_____________种。
(7)符合下列条件的J的一种同分异构体结构简式为______________________。
①属于芳香族化合物,②不能与金属钠反应,③有3种不同化学环境的氢原子。
(8)已知: (R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以
(R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以 、
、![]() 为原料制备
为原料制备 的合成路线图。(合成路线流程图示例见本题题干)。
的合成路线图。(合成路线流程图示例见本题题干)。
 _______________
_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为![]()
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 原子半径大小:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)俄美科学家联合小组宣布合成出114号元素(FI)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置______________,属于金属元素还是非金属元素?____
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________________。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(1)元素⑦的氢化物与⑧的单质反应的离子方程式为__________。
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________。
(3)元素Fe的单质与⑦的氢化物高温下反应的化学方程式为___________。
(III)判断以下叙述正确的是__________。
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
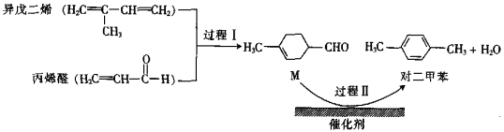
下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出___________kJ 的热量。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式.
(1)铁与水蒸气在高温下:_____
(2)苛性钠腐蚀玻璃:_____
(3)制取漂白粉:_____
(4)稀硝酸与铜片:_____
(5)氨的催化氧化:_____
(6)铜片在浓硫酸中加热:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向体积均为100mL、浓度均为1mol/L的NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下图所示:
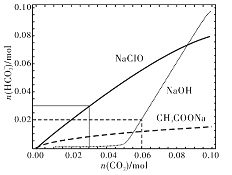
下列分析正确的是
A. CO2通入NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入CH3COONa溶液的反应:CO2+H2O+CH3COO-=HCO3-+CH3COOH
C. 通入n(CO2)=0.06mol时,NaOH溶液中的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.03mol时,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.03mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com