
【题目】分别向体积均为100mL、浓度均为1mol/L的NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下图所示:
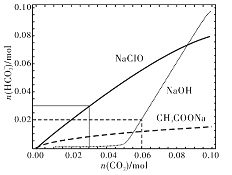
下列分析正确的是
A. CO2通入NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入CH3COONa溶液的反应:CO2+H2O+CH3COO-=HCO3-+CH3COOH
C. 通入n(CO2)=0.06mol时,NaOH溶液中的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.03mol时,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.03mol
【答案】D
【解析】
A.次氯酸的酸性大于碳酸氢根离子,所以反应生成次氯酸和碳酸氢根离子,则少量二氧化碳通入NaClO溶液中反应的离子方程式为:CO2+H2O+ClO-=HCO3-+HClO,A错误;
B.碳酸的酸性比醋酸弱,CO2通入CH3COONa溶液不反应,B错误;
C.n(NaOH)=0.1mol,通入n(CO2)=0.06mol,反应产物为碳酸氢钠和碳酸氢钠,反应的离子方程式:5OH-+3CO2=2CO32-+HCO3-+2H2O,C错误;
D.通入n(CO2)=0.03mol,三种溶液中存在碳元素的物料守恒得到:n(HCO3-)+n(CO32-)+n(H2CO3)=0.03mol l,D正确;
故合理选项是D。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)元素A、B、C中,电负性最大的是____(填元素符号,下同),元素B、C、D第一电离能由大到小的顺序为________。
(2)与同族其它元素X形成的XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28′(填“>”“<”或“=”),原因是________。
(3)BC3-离子中B原子轨道的杂化类型为____________,BC3-离子的立体构型为________________。
(4)基态E原子的电子排布式为________;C、E形成的化合物EC5(其中E的化合价为+6)中σ键与π键数目之比为________;
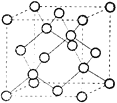
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为_____g·cm-3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A. X使蔗糖变黑的现象主要体现了X的脱水性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、高压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH-、![]() 、Cl-七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
、Cl-七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
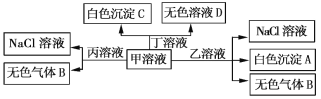
A. 白色沉淀A可能能溶解在溶液D中
B. 甲与丁可能发生反应:![]() +Ba2+ +OH-
+Ba2+ +OH-![]() BaCO3↓+H2O
BaCO3↓+H2O
C. 丙溶液与S2-、![]() 、
、![]() 可以大量共存
可以大量共存
D. 甲溶液中一定满足:c(H2CO3)+c(H+)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要100mL、1.00mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液冷却到室温后,小心转入A;
③继续加蒸馏水至液面离瓶颈刻度线1~2cm处,改用B小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入仪器A中,并轻轻摇匀;⑤将仪器A塞紧,充分摇匀。
(1)请书写操作②③所使用的仪器:A:____________、B:___________(填仪器名称)
(2)在仪器A上需标记的是___________________________________________
(3)操作步骤正确的顺序是____________________(填序号)。
(4)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为_____________
(5)现用Na2CO3固体配制以上Na2CO3溶液,则需称量Na2CO3___________ g
(6)在配制100mL、0.1mol/L的Na2CO3溶液时,下列操作中的________会导致结果偏低(请用序号填写)。
a.用托盘天平称量时砝码放在左盘
b.将烧杯中的溶液转移到仪器A时不慎洒到仪器A外
c.定容时俯视刻度线
d.定容时仰视刻度线
e.干净的仪器A未经干燥就用于配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化锰与浓盐酸反应制备氯气,并将Cl2通入较浓的NaOH和H2O2的混合液中。产生的ClO-被H2O2还原,发生激烈反应,产生较高能量的O2,随即它又转变为普通O2,并发出红光。进行此项实验所用主要仪器如下,请回答:

(1)氯气发生器中的的仪器a的名称是__。通过橡胶管将整套装置连接起来的正确顺序为:__。(用仪器的序号表示)
(2)实验开始前,必做的一项操作是__。
(3)仪器①中ClO-与H2O2反应的离子方程式为__。
(4)仪器②中试剂的主要作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
容器 | 温度/℃ | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | |||
n(CO2) | n(CH4) | n(CO) | n(H2) | n(H2) | ||
Ⅰ | T1 | 0 | 0.8 | 0.8 | 0.8 | 0.6 |
Ⅱ | T1 | 1.2 | 1.2 | 1.2 | 1.2 | / |
Ⅲ | T2 | 1.0 | 2.0 | 0 | 0 | 1.0 |
Ⅳ | T2 | 0.5 | 1.0 | 0 | 0 | / |
下列说法正确的是( )
A. T1>T2
B. 容器Ⅱ起始时的反应速率:v(正)>v(逆)
C. 容器Ⅰ、Ⅲ达到平衡时,容器内气体总压强之比:p(Ⅰ)∶p(Ⅲ) =11∶20
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com