
【题目】H+、Na+、Al3+、Ba2+、OH-、![]() 、Cl-七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
、Cl-七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
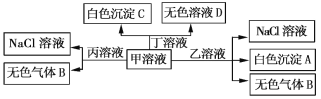
A. 白色沉淀A可能能溶解在溶液D中
B. 甲与丁可能发生反应:![]() +Ba2+ +OH-
+Ba2+ +OH-![]() BaCO3↓+H2O
BaCO3↓+H2O
C. 丙溶液与S2-、![]() 、
、![]() 可以大量共存
可以大量共存
D. 甲溶液中一定满足:c(H2CO3)+c(H+)=c(OH-)+c(![]() )
)
【答案】C
【解析】
A、由框图可知,甲溶液与乙溶液反应得到NaCl溶液、白色沉淀以及无色气体,则甲和乙中含有钠元素和氯元素,再结合题给条件中的七种离子可推出,甲和乙分别是NaHCO3和AlCl3中的一种,则丙和丁中含有剩余的离子Ba2+、OH、H+,再由框图可知,甲溶液与丙溶液反应生成NaCl溶液和无色气体,则甲为NaHCO3,乙为AlCl3,丙为HCl,丁为Ba(OH)2。白色沉淀A为Al(OH)3,D溶液中可能含有NaOH,Al(OH)3+NaOHNaAlO2+2H2O,故A说法正确;B、当丁[Ba(OH)2]过量时发生反应:NaHCO3+Ba(OH)2BaCO3↓+NaOH+H2O,故B说法正确;C、溶液丙为盐酸,H+、![]() 与I能发生氧化还原反应,不能大量共存,故C说法错误;溶液甲为NaHCO3溶液,溶液中存在电荷守恒式:c(Na+)+c(H+)=c(
与I能发生氧化还原反应,不能大量共存,故C说法错误;溶液甲为NaHCO3溶液,溶液中存在电荷守恒式:c(Na+)+c(H+)=c(![]() )+c(OH)+2c(
)+c(OH)+2c(![]() ),溶液中存在物料守恒式:c(Na+)=c(
),溶液中存在物料守恒式:c(Na+)=c(![]() )+c(H2CO3)+c(
)+c(H2CO3)+c(![]() ),两式联立得c(H2CO3)+c(H+)=c(OH)+c(
),两式联立得c(H2CO3)+c(H+)=c(OH)+c(![]() ),故D说法正确。
),故D说法正确。


科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
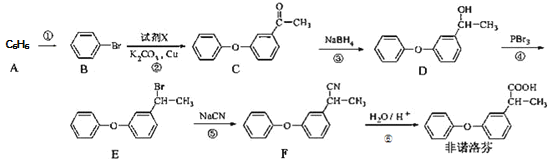
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
回答下列问题
(1)![]() 的化学名称是_____________,
的化学名称是_____________,![]() 中含氧官能团的名称为___________。
中含氧官能团的名称为___________。
(2)上述反应中,反应①的条件是___________,过程①属于______反应
(3)反应②发生的是取代反应,且另一种产物有![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式______。
的化学方程式______。
(4)有机物![]() 与非诺芬互为同分异构体,
与非诺芬互为同分异构体,![]() 满足下列条件:
满足下列条件:
I.能与NaHCO3溶液反应,且能与FeCl3溶液发生显色反应
II.分子中有6种不同化学环境的氢,且分子中含有两个苯环
![]() 的结构有_____种,写出其中一种不能与浓溴水发生取代反应的
的结构有_____种,写出其中一种不能与浓溴水发生取代反应的![]() 的结构简式_________。
的结构简式_________。
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 路线流程图(无机试剂任用)_________
路线流程图(无机试剂任用)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列各实验装置进行相应的实验,能达到实验目的的是
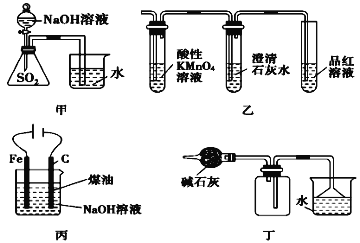
A. 用图甲装置证明SO2与NaOH溶液发生了反应
B. 用图乙装置检验某混合气体是否由SO2和CO2混合而成
C. 用图丙装置制备Fe(OH)2并能较长时间观察其颜色
D. 用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL1mol/L的稀硫酸。其实验过程如下:
①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为_______;
②配制稀硫酸时所需要浓硫酸体积为_______mL,用_______量筒(“100 mL”或 “10 mL”)量取浓硫酸;
③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌;
④将____________的上述溶液沿玻璃棒注入100 mL的容量瓶中,并用50mL蒸馏水分2~3次洗涤烧杯,洗涤液也注入容量瓶中,并摇匀;
⑤加水至距刻度线1~2cm时,改用_____________加水,使溶液凹液面跟刻度相平。
(2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为__________(列出计算式即可)。(已知:浓硫酸的质量分数为98%,密度为1.84 g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向体积均为100mL、浓度均为1mol/L的NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下图所示:
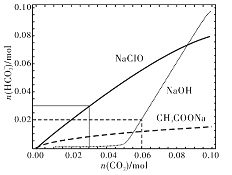
下列分析正确的是
A. CO2通入NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入CH3COONa溶液的反应:CO2+H2O+CH3COO-=HCO3-+CH3COOH
C. 通入n(CO2)=0.06mol时,NaOH溶液中的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.03mol时,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.03mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列判断正确的是( )
A.22.4L氯气中含有的Cl数目为2NA
B.1.0mol/LCaCl2溶液中含有的Cl-数目为2NA
C.7.8gNa2O2晶体中含有的Na+数目为0.1NA
D.2.0g重水(2H216O)中含有的中子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为X极:CH4+10OH--8e-=CO32—+7H2O; Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.该电池工作时,X极附近溶液的碱性增强
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.工作一段时间后,KOH的物质的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是
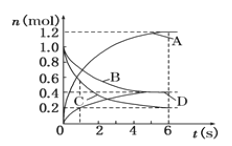
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1s时,v(A)=v(D)
C. 0~6s内,B的平均反应速率为0.05mol·L-1·s-1
D. 反应进行到6s时,B的转化率为40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com