
【题目】一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为X极:CH4+10OH--8e-=CO32—+7H2O; Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.该电池工作时,X极附近溶液的碱性增强
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.工作一段时间后,KOH的物质的量减少
【答案】B
【解析】
A.根据电极反应式X极:CH4+10OH--8e-═CO32-+7H2O,Y极:4H2O+2O2+8e-═8OH-可知,X极甲烷被氧化,应为原电池的负极反应,Y极氧气得电子被还原,应为原电池的正极反应,故A正确;
B.根据电极反应式X极:CH4+10OH--8e-═CO32-+7H2O,可知反应消耗KOH,OH-浓度减小,则pH减小,碱性减弱,故B错误;
C.n(O2)=![]() ,转移电子的物质的量为0.25mol×4=1mol,故C正确;
,转移电子的物质的量为0.25mol×4=1mol,故C正确;
D.X极:CH4+10OH--8e-═CO32-+7H2O,Y极:4H2O+2O2+8e-═8OH-,则总反应:CH4+2O2+2OH-=CO32-+3H2O,氢氧化钾被消耗,物质的量减小,故D正确;
故选:B。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH-、![]() 、Cl-七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
、Cl-七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
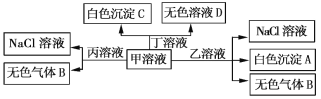
A. 白色沉淀A可能能溶解在溶液D中
B. 甲与丁可能发生反应:![]() +Ba2+ +OH-
+Ba2+ +OH-![]() BaCO3↓+H2O
BaCO3↓+H2O
C. 丙溶液与S2-、![]() 、
、![]() 可以大量共存
可以大量共存
D. 甲溶液中一定满足:c(H2CO3)+c(H+)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化锰与浓盐酸反应制备氯气,并将Cl2通入较浓的NaOH和H2O2的混合液中。产生的ClO-被H2O2还原,发生激烈反应,产生较高能量的O2,随即它又转变为普通O2,并发出红光。进行此项实验所用主要仪器如下,请回答:

(1)氯气发生器中的的仪器a的名称是__。通过橡胶管将整套装置连接起来的正确顺序为:__。(用仪器的序号表示)
(2)实验开始前,必做的一项操作是__。
(3)仪器①中ClO-与H2O2反应的离子方程式为__。
(4)仪器②中试剂的主要作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照给定元素的位置,回答下列问题:
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素④、⑤、⑥的原子半径由大到小的顺序为___(用元素符号表示)。
(2)元素③、⑦的最高价含氧酸的酸性由强到弱的顺序为__。(用化学式表示)
(3)碱性强弱比较:元素⑤的氢氧化物__⑥的氢氧化物(用<、=、>填空);两者相互反应的离子方程式为__。
(4)由元素⑤和⑧共同组成的化合物的电子式为__、它属于__化合物。(填“共价”或“离子”)
(5)由元素①⑧形成的化合物A和由元素④⑤⑧的化合物B,可相互反应产生黄绿色气体单质,该反应的离子方程式为__;该黄绿色气体单质会使得湿润淀粉碘化钾试纸变蓝色,表明生成了碘单质(I2),由此推测这两种元的气态氢化物的稳定性强弱顺序为:__。(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气__ mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Ca(CH3COO)2溶液与硫酸反应:Ca2++SO42-=CaSO4↓
B. Cl2与热的NaOH溶液反应:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
C. 电解K2MnO4碱性溶液制KMnO4:2MnO42-+2H+![]() 2MnO4-+H2↑
2MnO4-+H2↑
D. NaHCO3与过量Ba(OH)2溶液反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)基态Ga原子中有_____种能量不同的电子,其价电子排布式为_________。
(2)第四周期的主族元素中,基态原子未成对电子数与镓相同的元素有_______(填元素符号)。
(3)三甲基镓[(CH3)3Ga]是制备有机镓化合物的中间体。
①在700℃时,(CH3)3Ga和AsH3反应得到GaAs,化学方程式为____________________。
②(CH3)3Ga中Ga原子的杂化方式为__________;AsH3的空间构型是________________。
(4)GaF3的熔点为1000℃,GaC13的熔点为77.9℃,其原因是_______________________。
(5)砷化镓是半导体材料,其晶胞结构如图所示。
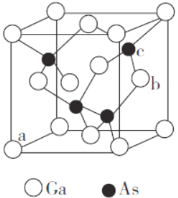
①晶胞中与Ga原子等距离且最近的As原子形成的空间构型为_______。
②原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中a(0,0,0)、b(1,![]() ),则c原子的坐标参数为______________。
),则c原子的坐标参数为______________。
③砷化镓的摩尔质量为M g·mol-1,Ga的原子半径为p nm,则晶体的密度为____g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com