
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
【答案】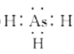 6:1 —2.2
6:1 —2.2 ![]() 4.5 2b—2a > 0.8 8.192×10-2
4.5 2b—2a > 0.8 8.192×10-2
【解析】
(1)ASH3的电子式与氨气类似;AsH3通入AgNO3溶液中可生成Ag,As2O3和HNO3,反应为2AsH3+12AgNO3+3H2O═As2O3+12Ag↓+12HNO3,据此分析;
(2)三元弱酸H3AsO4的三级电离反应为:H3AsO4H++H2ASO4-,H2ASO4-H++HAsO42-,HAsO42-H++AsO43-,
①Kal(H3AsO4)=![]() ,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,可得,用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,据此书写;
,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,可得,用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,据此书写;
②同理,Ka2(H2ASO4-)=![]() ,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=
,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=![]() ,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
反应H2AsO4-+AsO43-2HAsO42-的K=![]() =
=![]() ×
×![]() =
= ![]() ,据此计算;
,据此计算;
(3)已知:Ⅰ、As2O3(g)+3C(s)=2As(g)+3CO(g)△H1= akJmol-1
ⅡAs2O3(g)+3C(s)=![]() As4(g)+CO(g)△H2 = b kJmol-1
As4(g)+CO(g)△H2 = b kJmol-1
根据盖斯定律:Ⅱ×2-Ⅰ×2得反应4As(g)As4(g),据此计算;
(4)①A点达到平衡,B点处气体总压小于平衡时的气压,据此分析;
②A点处,气体总压的对数值lg(p/kPa),则气体总压为1kPa,AsS(g)在气体中体积分数为![]() ,由此可得;得出平衡时AsS(g)的分压为和S2(g)的分压,再计算Kp。
,由此可得;得出平衡时AsS(g)的分压为和S2(g)的分压,再计算Kp。
(1)ASH3的电子式与氨气类似,电子式为: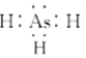 ;AsH3通入AgNO3溶液中可生成Ag,As2O3和HNO3,反应为2AsH3+12AgNO3+3H2O═As2O3+12Ag↓+12HNO3,其实As元素化合价升高被氧化,AsH3为还原剂,Ag元素化合价降低被还原,AgNO3为还原剂,氧化剂与还原剂的物质的量之比为6:1;
;AsH3通入AgNO3溶液中可生成Ag,As2O3和HNO3,反应为2AsH3+12AgNO3+3H2O═As2O3+12Ag↓+12HNO3,其实As元素化合价升高被氧化,AsH3为还原剂,Ag元素化合价降低被还原,AgNO3为还原剂,氧化剂与还原剂的物质的量之比为6:1;
故答案为: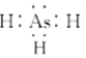 ;6:1;
;6:1;
(2)三元弱酸H3AsO4的三级电离反应为:H3AsO4H++H2ASO4-,H2ASO4-H++HAsO42-,HAsO42-H++AsO43-,第一步电离为主,
①Kal(H3AsO4)=![]() ,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,则1gKal(H3AsO4)=-2.2;用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,离子反应为:H3AsO4+OH-=H2ASO4-+H2O;
,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,则1gKal(H3AsO4)=-2.2;用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,离子反应为:H3AsO4+OH-=H2ASO4-+H2O;
故答案为:-2.2;H3AsO4+OH-=H2ASO4-+H2O;
②同理,Ka2(H2ASO4-)=![]() ,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=
,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=![]() ,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
反应H2AsO4-+AsO43-2HAsO42-的K=![]() =
=![]() ×
×![]() =
= ![]() =
=![]() =104.5,lgK═4.5;
=104.5,lgK═4.5;
故答案为:4.5;
(3)已知:Ⅰ、As2O3(g)+3C(s)=2As(g)+3CO(g)△H1=a kJmol-1
ⅡAs2![]() As4(g)+CO(g)△H2=b kJmol-1
As4(g)+CO(g)△H2=b kJmol-1
根据盖斯定律:Ⅱ×2-Ⅰ×2得4As(g)As4(g)△H=(2b-2a)kJmol-1;
故答案为:2b-2a;
(4)①A点达到平衡,B点处气体总压小于平衡时的气压,说明生成气体比平衡时少,反应正向着正方向生成气体的方向进行,故B点的反应速率v(正)>v(逆);
故答案为:>;
②A点处,气体总压的对数值lg(p/kPa),则气体总压为1kPa,AsS(g)在气体中体积分数为![]() ,S2(g)在气体中体积分数为
,S2(g)在气体中体积分数为![]() ,则AsS(g)的分压为0.8kPa,S2(g)的分压为0.2kPa,Kp=(0.8kPa)4×0.2kPa=8.192×10-2kPa5;
,则AsS(g)的分压为0.8kPa,S2(g)的分压为0.2kPa,Kp=(0.8kPa)4×0.2kPa=8.192×10-2kPa5;
故答案为:0.8;8.192×10-2。


科目:高中化学 来源: 题型:
【题目】1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
A.504mLB.336mLC.224mLD.168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出___________kJ 的热量。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式.
(1)铁与水蒸气在高温下:_____
(2)苛性钠腐蚀玻璃:_____
(3)制取漂白粉:_____
(4)稀硝酸与铜片:_____
(5)氨的催化氧化:_____
(6)铜片在浓硫酸中加热:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
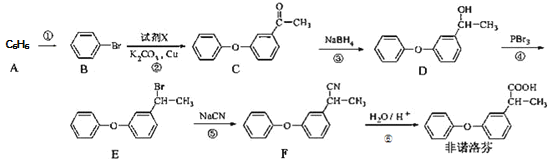
回答下列问题
(1)![]() 的化学名称是_____________,
的化学名称是_____________,![]() 中含氧官能团的名称为___________。
中含氧官能团的名称为___________。
(2)上述反应中,反应①的条件是___________,过程①属于______反应
(3)反应②发生的是取代反应,且另一种产物有![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式______。
的化学方程式______。
(4)有机物![]() 与非诺芬互为同分异构体,
与非诺芬互为同分异构体,![]() 满足下列条件:
满足下列条件:
I.能与NaHCO3溶液反应,且能与FeCl3溶液发生显色反应
II.分子中有6种不同化学环境的氢,且分子中含有两个苯环
![]() 的结构有_____种,写出其中一种不能与浓溴水发生取代反应的
的结构有_____种,写出其中一种不能与浓溴水发生取代反应的![]() 的结构简式_________。
的结构简式_________。
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 路线流程图(无机试剂任用)_________
路线流程图(无机试剂任用)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列各实验装置进行相应的实验,能达到实验目的的是
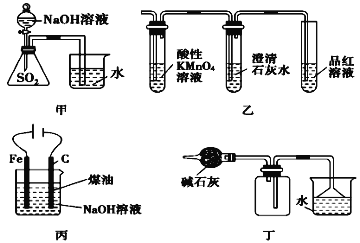
A. 用图甲装置证明SO2与NaOH溶液发生了反应
B. 用图乙装置检验某混合气体是否由SO2和CO2混合而成
C. 用图丙装置制备Fe(OH)2并能较长时间观察其颜色
D. 用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为X极:CH4+10OH--8e-=CO32—+7H2O; Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.该电池工作时,X极附近溶液的碱性增强
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.工作一段时间后,KOH的物质的量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com