
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】科学家研发出了一种新材料,其工作原理如图所示。在外接电源作用下,材料内部发生氧化还原反应导致颜色变化,从而实现对光的透过率进行可逆性调节。已知WO3和Li4Fe4[Fe(CN6]3均为无色透明,LiWO3和Fe4[Fe(CN6]3均有颜色。下列说法正确的是( )

A. 当M外接电源正极时,该材料颜色变深使光的透过率降低
B. 该材料在使用较长时间后,离子导电层中Li+的量变小
C. 当M外接电源负极时,离子导电层中的Li+向变色导电层定向迁移
D. 当N外接电源正极时,离子储存层的电极反应式为:Fe4[Fe(CN6]3+4Li++4eˉ= Li4Fe4[Fe(CN6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 中和pH和体积都相同的硝酸和醋酸溶液,消耗NaOH的物质的量之比为1∶1
C. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(H2CO3)
)>c(H2CO3)
D. pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日IPCC发布了由来自40个国家的91位科学家编写的《全球升温1.5℃特别报告》,温室效应引发的环境问题日益严重,物种灭绝,洪灾、旱灾、粮食欠收等自然灾害发生频率不断增加,CO2的减排和综合利用是解决温室及能源问题的有效途径。
(1)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
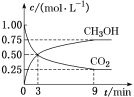
① 从3 min到9 min,v(H2)=_____mol·L-1·min-1。
② 该反应的平衡常数为_______。
③ 下列说法正确的的是____(填字母)。
A.混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态
B.平衡时CO2的转化率为75%
C.平衡时混合气体中CH3OH(g)的体积分数是30%
D.该条件下,第9 min时v逆(CH3OH)大于第3 min时v正(CH3OH)。
(2)工业中,CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。
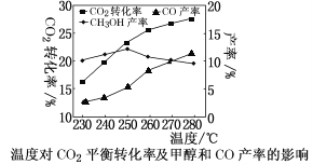
① 由图可知温度升高CO的产率上升,其主要原因可能是________。
② 由图可知获取CH3OH最适宜的温度是________。下列措施有利于提高CO2转化为CH3OH的平衡转化率的有___________(填字母)。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
(3)250 ℃下CH3OH物质的量随时间的变化曲线如图所示。画出280 ℃下0~t2时刻CH3OH物质的量随时间的变化曲线示意图__________。
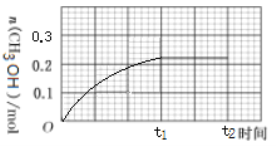
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1D.SO3为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的合金及其配合物用途非常广泛。已知Co3+比Fe3+的氧化性更强,在水溶液中不能大量存在。
(1)Co3+的核外电子排布式为__________________________。
(2)无水CoCl2的熔点为735℃、沸点为1049℃,FeCl3熔点为306℃、沸点为315℃。CoCl2属于_________晶体,FeCl3属于__________晶体。
(3)BNCP可用于激光起爆器等,可由HClO4、CTCN、NaNT共反应制备。
①![]() 的空间构型为______________。
的空间构型为______________。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_______{已知 ![]() 的结构式为
的结构式为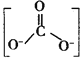 }。
}。
③NaNT可以![]() (双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(4)Co与CO作用可生成Co2(CO)8,其结构如图所示。该分子中C原子的杂化方式为_________________。
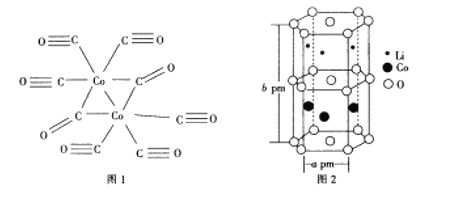
(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为___________。已知NA为阿伏加德罗常数的数值,则该晶胞的密度为__________(用含a、b、NA的代数式表示)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
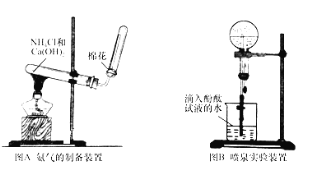
(1)根据图A写出实验室制取氨气的化学方程式_____;
(2)收集氨时,试管口棉花的作用_____;验满的方法是_____;收集干燥的氨时,使用的干燥剂是_____;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是_____.
A、氢气 B、氧气 C、氯气 D、二氧化碳
(4)图B装置进行喷泉实验,烧瓶中充满氨气,引发水上喷的操作是_____;所得溶液呈_____性 (填“酸”、“碱”或“中” ),解释原因 (用化学方程式表示 )_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照给定元素的位置,回答下列问题:
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素④、⑤、⑥的原子半径由大到小的顺序为___(用元素符号表示)。
(2)元素③、⑦的最高价含氧酸的酸性由强到弱的顺序为__。(用化学式表示)
(3)碱性强弱比较:元素⑤的氢氧化物__⑥的氢氧化物(用<、=、>填空);两者相互反应的离子方程式为__。
(4)由元素⑤和⑧共同组成的化合物的电子式为__、它属于__化合物。(填“共价”或“离子”)
(5)由元素①⑧形成的化合物A和由元素④⑤⑧的化合物B,可相互反应产生黄绿色气体单质,该反应的离子方程式为__;该黄绿色气体单质会使得湿润淀粉碘化钾试纸变蓝色,表明生成了碘单质(I2),由此推测这两种元的气态氢化物的稳定性强弱顺序为:__。(用化学式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com