
【题目】钴的合金及其配合物用途非常广泛。已知Co3+比Fe3+的氧化性更强,在水溶液中不能大量存在。
(1)Co3+的核外电子排布式为__________________________。
(2)无水CoCl2的熔点为735℃、沸点为1049℃,FeCl3熔点为306℃、沸点为315℃。CoCl2属于_________晶体,FeCl3属于__________晶体。
(3)BNCP可用于激光起爆器等,可由HClO4、CTCN、NaNT共反应制备。
①![]() 的空间构型为______________。
的空间构型为______________。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_______{已知 ![]() 的结构式为
的结构式为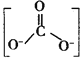 }。
}。
③NaNT可以![]() (双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
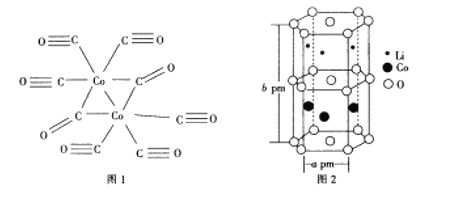
(4)Co与CO作用可生成Co2(CO)8,其结构如图所示。该分子中C原子的杂化方式为_________________。
(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为___________。已知NA为阿伏加德罗常数的数值,则该晶胞的密度为__________(用含a、b、NA的代数式表示)g·cm-3。
【答案】[Ar]3d6或1s22s22p63s23p63d6 离子 分子 正四面体 N和O 9NA(或9×6.02×1023) sp和sp2 6 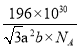
【解析】
(1)Co是27号元素,其原子核外有27个电子,失去3d上1个电子和4s上2个电子生成Co3+离子,根据构造原理知Co3+基态的电子排布式;
(2)分子晶体熔沸点较低,离子晶体熔沸点较高,据此解答;
(3)根据价层电子对互斥理论作答;
(4)根据图示Co2(CO)8的结构式结合杂化轨道理论作答;
(5)先通过数学几何关系计算出六棱柱的体积,再利用“均摊法”求出该晶胞中O原子、Li原子和Co原子的数目,最后利用晶体密度![]() =
=![]() 计算求出结论。
计算求出结论。
(1)Co位于第四周期第VIII族,基态Co的价电子排布式为3d74s2,Co3+核外电子排布式为 [Ar]3d6或1s22s22p63s23p63d6;
(2)无水CoCl2的熔点为735℃、沸点为1049℃,符合离子晶体的特点;FeCl3熔点为306℃、沸点为315℃,符合分子晶体的特点,则CoCl2属于离子晶体,FeCl3属于分子晶体;
(3)①ClO4-中心原子Cl有4个σ键,孤电子对数为(7+1-4×2)/2=0,价层电子对数为4,ClO4-的空间构型为正四面体;
②构成配位键,和中心原子提供空轨道,配原子提供孤电子对,根据CTCN的化学式,以及CO32-的结构式,与Co(III)形成配位键的原子是N和O;
③前一个C原子,有3个σ键,无孤电子对,杂化类型为sp2,后一个碳原子有2个σ键,无孤电子对,杂化类型为sp;成键原子之间只能形成一个σ键,即1mol该分子中含有σ键物质的量为9 mol,个数为9NA或9×6.02×1023。
(4)图中以碳氧双键存在的中心C原子是平面结构,C的价电子数=3+0=3,则采用sp2杂化方式;以碳氧三键存在的中心C原子是直线型结构,C的价电子数=2+0=2,则采用sp杂化方式,故答案为:sp和sp2;
题图中原子的堆积方式为六方最密堆积。1pm=1010cm,六棱柱底部正六边形的面积=6![]() (a×10-10)2cm2,六棱柱的体积=6
(a×10-10)2cm2,六棱柱的体积=6![]() (a×10-10)2(b×10-10)cm3=3
(a×10-10)2(b×10-10)cm3=3![]() a2b×10-30cm3。该晶胞中氧原子的数目为12
a2b×10-30cm3。该晶胞中氧原子的数目为12![]() +6
+6![]() +2
+2![]() +1=6,Li原子的数目为3,Co原子的数目为3,已知
+1=6,Li原子的数目为3,Co原子的数目为3,已知![]() 为阿伏加德罗常数的数值,则一个晶胞的质量为
为阿伏加德罗常数的数值,则一个晶胞的质量为![]() g,故密度为
g,故密度为![]() =
=![]() =
=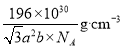 。
。
因此,本题正确答案是:![]()


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2在密闭容器中反应,经过tmin后,测得物质的浓度分别为:c(X2)=0.4mol·L-1,c(Y2)=0.8mol·L-1,则该反应的方程式可表示为()
A. X2+2Y2![]() 2XY2B. 2X2+Y2
2XY2B. 2X2+Y2![]() 2X2Y
2X2Y
C. X2+3Y2![]() 2XY3D. 3X2+Y2
2XY3D. 3X2+Y2![]() 2X3Y
2X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
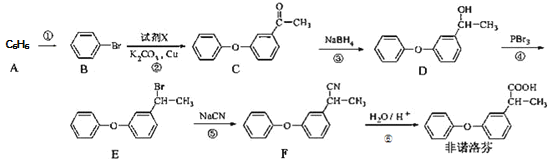
回答下列问题
(1)![]() 的化学名称是_____________,
的化学名称是_____________,![]() 中含氧官能团的名称为___________。
中含氧官能团的名称为___________。
(2)上述反应中,反应①的条件是___________,过程①属于______反应
(3)反应②发生的是取代反应,且另一种产物有![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式______。
的化学方程式______。
(4)有机物![]() 与非诺芬互为同分异构体,
与非诺芬互为同分异构体,![]() 满足下列条件:
满足下列条件:
I.能与NaHCO3溶液反应,且能与FeCl3溶液发生显色反应
II.分子中有6种不同化学环境的氢,且分子中含有两个苯环
![]() 的结构有_____种,写出其中一种不能与浓溴水发生取代反应的
的结构有_____种,写出其中一种不能与浓溴水发生取代反应的![]() 的结构简式_________。
的结构简式_________。
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 路线流程图(无机试剂任用)_________
路线流程图(无机试剂任用)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如图:

已知:① +HCl(R代表烃基)
+HCl(R代表烃基)
②![]() +R’OH
+R’OH![]() +RCOOH(R、R’代表烃基)
+RCOOH(R、R’代表烃基)
③ (R、R1、R2、R3、R4代表烃基)
(R、R1、R2、R3、R4代表烃基)
(1)A的结构简式是__;根据系统命名法,F的名称是__。
(2)B→C所需试剂a是__;试剂b的结构简式是__。
(3)C与足量的NaOH反应的化学方程式为__。
(4)G与新制Cu(OH)2反应的化学方程式为__。
(5)已知:①2H![]() J+H2O;②J的核磁共振氢谱只有两组峰。
J+H2O;②J的核磁共振氢谱只有两组峰。
以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:

E:__;J:__;中间产物2:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL1mol/L的稀硫酸。其实验过程如下:
①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为_______;
②配制稀硫酸时所需要浓硫酸体积为_______mL,用_______量筒(“100 mL”或 “10 mL”)量取浓硫酸;
③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌;
④将____________的上述溶液沿玻璃棒注入100 mL的容量瓶中,并用50mL蒸馏水分2~3次洗涤烧杯,洗涤液也注入容量瓶中,并摇匀;
⑤加水至距刻度线1~2cm时,改用_____________加水,使溶液凹液面跟刻度相平。
(2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为__________(列出计算式即可)。(已知:浓硫酸的质量分数为98%,密度为1.84 g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com