
【题目】某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
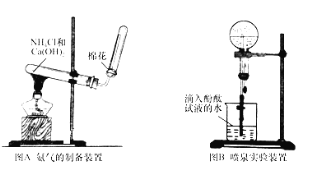
(1)根据图A写出实验室制取氨气的化学方程式_____;
(2)收集氨时,试管口棉花的作用_____;验满的方法是_____;收集干燥的氨时,使用的干燥剂是_____;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是_____.
A、氢气 B、氧气 C、氯气 D、二氧化碳
(4)图B装置进行喷泉实验,烧瓶中充满氨气,引发水上喷的操作是_____;所得溶液呈_____性 (填“酸”、“碱”或“中” ),解释原因 (用化学方程式表示 )_____。
【答案】2NH4Cl+Ca (OH )2![]() 2NH3↑+CaCl2+2H2O 防止与空气对流收集不到纯净的氨气 将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝 (或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟 ) 碱石灰 B 打开止水夹,挤出胶头滴管中的水 碱 NH3+H2ONH3H2ONH4++OH﹣
2NH3↑+CaCl2+2H2O 防止与空气对流收集不到纯净的氨气 将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝 (或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟 ) 碱石灰 B 打开止水夹,挤出胶头滴管中的水 碱 NH3+H2ONH3H2ONH4++OH﹣
【解析】
(1)实验室通常用加热氢氧化钙与氯化铵的混合固体的方法制取氨气;(2)根据氨气的溶解性及密度确定氨气的收集方法;氨气有刺激性气味,能污染大气;氨气的水溶液显碱性;(3)根据实验室制取氨气选择固固加热装置,结合气体的反应原理来分析试剂和使用的仪器,从而确定装置;(4)氨气极易溶于水,形成压强差可以形成喷泉;据此分析解答。
(1)氨盐和碱反应生成氨气和水,实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,所以不能采用排水法收集氨气,氨气的密度小于空气且常温下和氧气不反应,根据装置图知,氨气采用向下排空气法收集;氨气有刺激性气味,能污染大气,为防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气,用棉花塞在试管口,检验氨气是否集满,可以利用氨气的水溶液显碱性,即用“使湿润的红色石蕊试纸变蓝”;也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟”,碱石灰是固体氢氧化钠和氧化钙的混合物,氨气不能与碱石灰反应,且碱石灰能吸水,所以用碱石灰作干燥剂,故答案为:防止与空气对流收集不到纯净的氨气;将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝(或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟);碱石灰;
(3)实验室制取氨气,用的是固体与固体反应,需要加热,应该使用硬质大试管作反应器。A、实验室制取氢气,是用锌与稀硫酸反应,不需要加热,故A不选;B、实验室制取氧气,可以用加热氯酸钾(用二氧化锰作催化剂)或高锰酸钾的方法,要使用加热固体反应物的装置,可以使用硬质大试管作反应器,故B选;C、实验室制取氯气用浓盐酸与二氧化锰固体反应,需要加热,属于固液加热,使用分液漏斗和烧瓶,故C不选;D、实验室制取二氧化碳,用的是碳酸钙与稀盐酸反应,不需要加热,故D不选;因此实验室制取氧气和氨气的实验装置相同,故答案为:B;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,氨气和水反应生成一水合氨,反应为:NH3+H2ONH3H2O,一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子,电离方程式为NH3H2ONH4++OH-,溶液呈碱性,故答案为:打开止水夹,挤出胶头滴管中的水;碱;NH3+H2ONH3H2ONH4++OH-。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. a—定由W、X两种元素组成
D. 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
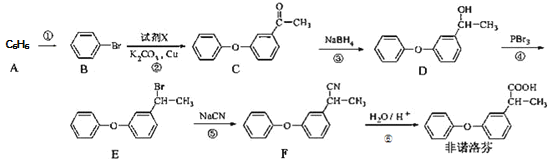
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
回答下列问题
(1)![]() 的化学名称是_____________,
的化学名称是_____________,![]() 中含氧官能团的名称为___________。
中含氧官能团的名称为___________。
(2)上述反应中,反应①的条件是___________,过程①属于______反应
(3)反应②发生的是取代反应,且另一种产物有![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式______。
的化学方程式______。
(4)有机物![]() 与非诺芬互为同分异构体,
与非诺芬互为同分异构体,![]() 满足下列条件:
满足下列条件:
I.能与NaHCO3溶液反应,且能与FeCl3溶液发生显色反应
II.分子中有6种不同化学环境的氢,且分子中含有两个苯环
![]() 的结构有_____种,写出其中一种不能与浓溴水发生取代反应的
的结构有_____种,写出其中一种不能与浓溴水发生取代反应的![]() 的结构简式_________。
的结构简式_________。
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 路线流程图(无机试剂任用)_________
路线流程图(无机试剂任用)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如图:

已知:① +HCl(R代表烃基)
+HCl(R代表烃基)
②![]() +R’OH
+R’OH![]() +RCOOH(R、R’代表烃基)
+RCOOH(R、R’代表烃基)
③ (R、R1、R2、R3、R4代表烃基)
(R、R1、R2、R3、R4代表烃基)
(1)A的结构简式是__;根据系统命名法,F的名称是__。
(2)B→C所需试剂a是__;试剂b的结构简式是__。
(3)C与足量的NaOH反应的化学方程式为__。
(4)G与新制Cu(OH)2反应的化学方程式为__。
(5)已知:①2H![]() J+H2O;②J的核磁共振氢谱只有两组峰。
J+H2O;②J的核磁共振氢谱只有两组峰。
以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:

E:__;J:__;中间产物2:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列各实验装置进行相应的实验,能达到实验目的的是
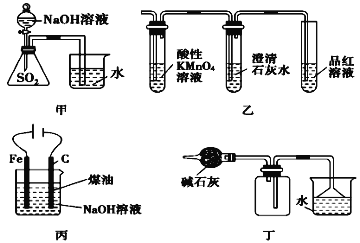
A. 用图甲装置证明SO2与NaOH溶液发生了反应
B. 用图乙装置检验某混合气体是否由SO2和CO2混合而成
C. 用图丙装置制备Fe(OH)2并能较长时间观察其颜色
D. 用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL1mol/L的稀硫酸。其实验过程如下:
①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为_______;
②配制稀硫酸时所需要浓硫酸体积为_______mL,用_______量筒(“100 mL”或 “10 mL”)量取浓硫酸;
③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌;
④将____________的上述溶液沿玻璃棒注入100 mL的容量瓶中,并用50mL蒸馏水分2~3次洗涤烧杯,洗涤液也注入容量瓶中,并摇匀;
⑤加水至距刻度线1~2cm时,改用_____________加水,使溶液凹液面跟刻度相平。
(2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为__________(列出计算式即可)。(已知:浓硫酸的质量分数为98%,密度为1.84 g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列判断正确的是( )
A.22.4L氯气中含有的Cl数目为2NA
B.1.0mol/LCaCl2溶液中含有的Cl-数目为2NA
C.7.8gNa2O2晶体中含有的Na+数目为0.1NA
D.2.0g重水(2H216O)中含有的中子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com