
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
【答案】(1)1s22s22p63s23p63d104s24p3 As(2)![]() (3)三角锥
(3)三角锥
(4)As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O (5)稳定性:NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定 沸点:NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高。
【解析】(1)X元素原子的4p轨道上有3个未成对电子,可通过写电子排布式得到X为33号元素As;(2) Y元素原子的最外层2p轨道上有2个未成对电子,同样根据电子排布式得到Y为O;再根据X、Y和Z三种元素的原子序数之和等于42可得到Z为H.(3)~(5)就不再分析了。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
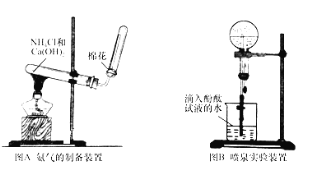
(1)根据图A写出实验室制取氨气的化学方程式_____;
(2)收集氨时,试管口棉花的作用_____;验满的方法是_____;收集干燥的氨时,使用的干燥剂是_____;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是_____.
A、氢气 B、氧气 C、氯气 D、二氧化碳
(4)图B装置进行喷泉实验,烧瓶中充满氨气,引发水上喷的操作是_____;所得溶液呈_____性 (填“酸”、“碱”或“中” ),解释原因 (用化学方程式表示 )_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照给定元素的位置,回答下列问题:
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素④、⑤、⑥的原子半径由大到小的顺序为___(用元素符号表示)。
(2)元素③、⑦的最高价含氧酸的酸性由强到弱的顺序为__。(用化学式表示)
(3)碱性强弱比较:元素⑤的氢氧化物__⑥的氢氧化物(用<、=、>填空);两者相互反应的离子方程式为__。
(4)由元素⑤和⑧共同组成的化合物的电子式为__、它属于__化合物。(填“共价”或“离子”)
(5)由元素①⑧形成的化合物A和由元素④⑤⑧的化合物B,可相互反应产生黄绿色气体单质,该反应的离子方程式为__;该黄绿色气体单质会使得湿润淀粉碘化钾试纸变蓝色,表明生成了碘单质(I2),由此推测这两种元的气态氢化物的稳定性强弱顺序为:__。(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气__ mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________(用化学式表示),原因是_____________________。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________。
(3)1 mol B2A2分子中含σ键的数目是____________。
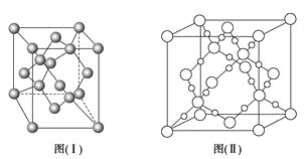
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____个原子,该晶体类型为________。
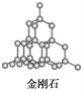
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______(填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Ca(CH3COO)2溶液与硫酸反应:Ca2++SO42-=CaSO4↓
B. Cl2与热的NaOH溶液反应:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
C. 电解K2MnO4碱性溶液制KMnO4:2MnO42-+2H+![]() 2MnO4-+H2↑
2MnO4-+H2↑
D. NaHCO3与过量Ba(OH)2溶液反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
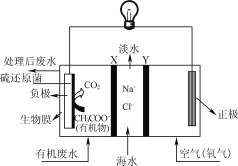
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.6gFe和足量的盐酸完全反应失去电子数为0.3NA
B.常温常压下,100g质量分数为17%的H2O2溶液中含氧原子数目为NA
C.14g晶体硅中含0.5NA个原子
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将下列物质与其对应的性质或用途连线。
物质与性质 | 物质与用途 |
SO2 黄色固体 NO2 黄绿色气体 Cl2 红棕色气体 S 无色气体 | 氨气 发酵粉 过氧化钠 漂白粉 碳酸氢钠 制冷剂 次氯酸钙 供氧剂 |
__________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com