
【题目】请将下列物质与其对应的性质或用途连线。
物质与性质 | 物质与用途 |
SO2 黄色固体 NO2 黄绿色气体 Cl2 红棕色气体 S 无色气体 | 氨气 发酵粉 过氧化钠 漂白粉 碳酸氢钠 制冷剂 次氯酸钙 供氧剂 |
__________________________________
【答案】
【解析】
二氧化硫是有刺激性气味的无色气体;
二氧化氮是有刺激性气味的红棕色气体;
氯气是是有刺激性气味的黄绿色气体;
硫是不溶于水的黄色固体;
液氨挥发时吸收热量,氨气常用做制冷剂;
过氧化钠能与二氧化碳和水反应生成氧气,常用做供氧剂;
碳酸氢钠受热能分解生成二氧化碳,是发酵粉的主要成分;
次氯酸钙能与空气中的二氧化碳和水反应生成具有强氧化性的次氯酸,是漂白粉的主要成分。
(1)物质与性质:
二氧化硫是有刺激性气味的无色气体,连线为二氧化硫——无色气体;
二氧化氮是有刺激性气味的红棕色气体,连线为二氧化氮——红棕色气体;
氯气是是有刺激性气味的黄绿色气体,连线为氯气——黄绿色气体;
硫是不溶于水的黄色固体,连线为硫——黄色固体;
(2)物质与用途:
液氨挥发时吸收热量,氨气常用做制冷剂,连线为氨气——制冷剂;
过氧化钠能与二氧化碳和水反应生成氧气,常用做供氧剂,连线为过氧化钠——供氧剂;
碳酸氢钠受热能分解生成二氧化碳,是发酵粉的主要成分,生活经常用它当发酵粉做馒头,连线为碳酸氢钠——发酵粉;
次氯酸钙能与空气中的二氧化碳和水反应生成具有强氧化性的次氯酸,是漂白粉的主要成分,连线为次氯酸钙——漂白粉;
故答案为:


科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物1-氧杂-2,4-环戊二烯(![]() )的说法正确的是
)的说法正确的是
A. 与![]() 互为同系物B. 二氯代物有3种
互为同系物B. 二氯代物有3种
C. 所有原子都处于同一平面内D. 1mol该有机物完全燃烧消耗5molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:苯酚与Fe3+在溶液中存在可逆反应:Fe3+ + 6C6H5OH![]() H3Fe(OC6H5) 6 + 3H+,其中H3Fe(OC6H5) 6显紫色。实验如下:
H3Fe(OC6H5) 6 + 3H+,其中H3Fe(OC6H5) 6显紫色。实验如下:
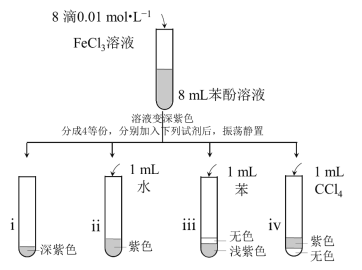
下列说法不正确的是:
A. i是空白对照实验
B. 向ii中滴加几滴浓盐酸,溶液颜色变浅
C. iii、iv中无色层中的溶剂分别为苯和CCl4
D. 苯酚在苯中的溶解性小于在CCl4中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向稀硫酸中逐滴加入氢氧化钡溶液过程中的电导率如图,下列说法不正确的是:

A.A点硫酸浓度最大
B.B点溶液中离子浓度小于A点
C.C点的导电率不为零是因为硫酸有剩余
D.D点溶液中的主要离子为Ba2+和OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物的“价-类”二维图如下:

(1)写出X、Y的化学式:____________、____________
(2)某小组设计实验对硫燃烧的产物及其性质进行验证,实验装置如下图所示。(胶头滴管中为氯化钡溶液)

a.湿润的蓝色石蕊试纸
b.湿润的品红试纸
c.湿润的Na2S试纸
将硫粉点燃后伸入瓶中盖紧胶塞。
①湿润的Na2S试纸上出现淡黄色固体,说明硫的燃烧产物有___________性。
②湿润的品红试纸褪色说明了__________(填化学式)有__________性。
③湿润的蓝色石蕊试纸变红的原因____________________(用化学方程式表示)
④滴入氯化钡溶液,出现少量白色沉淀,写出白色沉淀的化学式____________。
(3)从“价-类”二维的角度,分析Z可能的化学性质:
①从物质类别的角度具有________的通性。
②从化合价的角度具有_________________________________________。
(4)根据二维图探究硫元素转化时,某同学预测出如下转化:2H2O+2S+3O2=2H2SO4,请问该同学分析物质转化缺少的思维角度是:__________。(填字母序号)
a.物质类别角度 b.化合价角度 c.化合价及类别两个角度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下左图所示,其中甲池的总反应式为2CH3OH+302+4KOH=2K2CO3+6H20,完成下列问题:

(1)甲池燃料电池的负极反应为___________________。
(2)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生____g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
(4)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2 的实验装置(如上右图)。若用于制漂白液,a 为电池的______极,电解质溶液最好用_____。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com