
【题目】如下左图所示,其中甲池的总反应式为2CH3OH+302+4KOH=2K2CO3+6H20,完成下列问题:

(1)甲池燃料电池的负极反应为___________________。
(2)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生____g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
(4)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2 的实验装置(如上右图)。若用于制漂白液,a 为电池的______极,电解质溶液最好用_____。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___作电极。
【答案】 CH3OH-6e-+8OH-+8OH-=CO32-+6H2O 2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑ 1.16 1 负 饱和食盐水 铁(Fe)
2Cu+2H2SO4+O2↑ 1.16 1 负 饱和食盐水 铁(Fe)
【解析】(1)甲醇的燃料电池,甲醇在负极发生氧化反应,在碱性环境下变为碳酸根离子,极反应:CH3OH-6e-+8OH-=CO32-+6H2O;正确答案:CH3OH-6e-+8OH-=CO32-+6H2O。
(2)乙池为电解池,石墨做阳极,银做阴极;阳极极反应4OH--4e-=O2↑++2H2O,阴极极反应2Cu2++4e-=2Cu,两个反应相加,为总反应2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑;正确答案:2CuSO4+2H2O
2Cu+2H2SO4+O2↑;正确答案:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。
(3)丙池中用惰性电极电解氯化镁溶液总反应为MgCl2+2H2O==Mg(OH)2↓+Cl2↑+H2↑;甲池为原电池,总反应为2CH3OH+302+4KOH=2K2CO3+6H20,根据串联电路转移电子数相等规律可知:12e---6Mg(OH)2,12 e---3O2,消耗0.01molO2最终产生Mg(OH)20.02 mol,质量为0.02×58=1.16g;乙池反应2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,根据电子转移相等规律,根据关系式4e---2H2SO4可知,甲池转移电子为0.04 mol,乙池中产生H2SO40.02 mol,c(H+)=0.02×2÷0.4=0.1mol/L, 该溶液的pH=1,正确答案:1.16 ;1。
2Cu+2H2SO4+O2↑,根据电子转移相等规律,根据关系式4e---2H2SO4可知,甲池转移电子为0.04 mol,乙池中产生H2SO40.02 mol,c(H+)=0.02×2÷0.4=0.1mol/L, 该溶液的pH=1,正确答案:1.16 ;1。
(4)用惰性电极电解饱和食盐水,阳极产生氯气,阴极产生氢气,同时生成氢氧化钠溶液,氯气与氢氧化钠溶液反应生成次氯酸钠和氯化钠即为漂白液,所以a 为电池的负极,A处生成氢氧化钠溶液,B处产生氯气,直接反应生成漂白液;要产生Fe(OH)2,硫酸钠溶液作电解质,阳极材料为铁,失电子变为亚铁离子,才能够提供亚铁离子;正确答案:饱和食盐水;铁(Fe)。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】第二周期元素A和B能形成键角为180°的AB2气体分子,则下列推断正确的是( )
A. AB2分子的空间构型为直线形
B. AB2分子为极性分子
C. 熔点、沸点:AB2>H2O
D. AB2与SiO2的结构相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①溶液中粒子种类:Na2CO3溶液_____NaHCO3溶液(填“>”、“<”或“=”)。
②已知25℃时CO32-第一步水解的平衡常数K1=2×10-4mol/L.溶液中c(HCO3-):c(CO32-)=20:1时,溶液的pH=______。
③泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得IL溶液A,溶液B为0.1mol/LCH3COONa溶液,则两份溶液中c(NO3-)、c( NO2-)和c(CH3COO-)由小到大的顺序为___________(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是_____(填字母序号)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(3) SO2会引起酸雨,可利用氢氧化钠溶液吸收,吸收SO2的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显_______性,用化学平衡原理解释:______________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____
a. c(Na+)=2c(SO32-) +c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.(Na+)+c(H+)=c(SO32-)+c(HSO3-) +c(OH-)
③当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
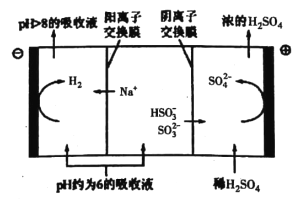
HSO3-在阳极放电的电极反应式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,集气瓶内充满某混合气体(括号内为体积比),若将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,则集气瓶中的混合气体可能是( )
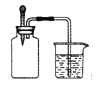
①CO、O2 (2:1) ②NH3 、O2(8:1)③NO2、O2(4:1) ④N2、H2(1:3)
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.Fe在氯气中燃烧生成FeCl2
B.将AlCl3溶液逐滴滴入到NaOH溶液,先产生白色沉淀,最后沉淀消失
C.电解氯化钠溶液制取金属单质钠
D.常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:
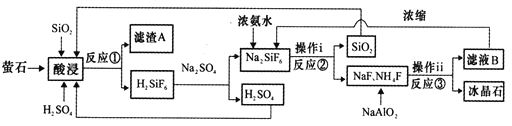
(1)Na3AlF6中氟、铝以共价键结合,写出Na3AlF6中所含阳离子的电子式________________,滤渣A的主要成分是_______________________(填名称)。
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:
实验编号 | 萤石品位 | 硫酸的 | 反应温度/℃ | 获得 Na2SiF6的质量 |
(CaF2含量) | 质量分数 | |||
1 | 96% | 25% | 60~70 | 120 |
2 | 96% | 35% | 60~70 | 153 |
3 | 96% | 35% | 80~90 | 100 |
4 | 96% | 40% | 60~70 | 141 |
①实验3比实验2获得Na2SiF6的质量低的原因可能是___________________。
②选择“酸浸”时所采用的最适合条件为____________________________。
(3)写出反应③的离子方程式:______________________________。
(4)“操作ⅰ”不能用硅酸盐质设备进行分离的原因__________________________。
(5)经测定,操作ⅰ所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+___________(填“是”或“否”)开始沉淀。(已知25℃时,Ksp(Na3AlF6)=4.0×10-10,Ksp(K3AlF6)=6.0·10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)用双线桥表示出电子转移的方向和数目________,题干中反应改写成离子方程式是____。
(2)电解食盐水的过程中,被还原的元素是____________,氧化产物是______。
Ⅱ.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________。
(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为____mol,被Fe2+还原的O2的物质的量为_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com