
【题目】Ⅰ.工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)用双线桥表示出电子转移的方向和数目________,题干中反应改写成离子方程式是____。
(2)电解食盐水的过程中,被还原的元素是____________,氧化产物是______。
Ⅱ.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________。
(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为____mol,被Fe2+还原的O2的物质的量为_____mol。
【答案】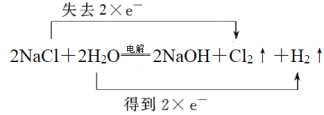 2Cl-+2H2O
2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑ 氢元素(或H) 氯气(或Cl2) Fe2+和S2O32- 4 4 0.5
2OH-+Cl2↑+H2↑ 氢元素(或H) 氯气(或Cl2) Fe2+和S2O32- 4 4 0.5
【解析】
根据反应中相关元素的化合价变化情况、氧化还原反应的有关概念以及原子守恒和电子转移守恒分析解答。
Ⅰ.(1)氯化钠中氯元素的化合价从-1价升高到0价,失去电子,水中氢元素化合价从+1价降低到0价,得到电子,根据电子转移守恒可知反应中转移2个电子,则用双线桥表示出电子转移的方向和数目为 ,反应的离子方程式为2Cl-+2H2O
,反应的离子方程式为2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑。
2OH-+Cl2↑+H2↑。
(2)电解食盐水的过程中,水中氢元素化合价从+1价降低到0价,得到电子,被还原的元素是氢元素。氯元素失去电子,发生氧化反应,氧化产物是氯气。
Ⅱ.(1)根据方程式可知水热法制备Fe3O4纳米颗粒的反应中铁元素和硫元素化合价升高,失去电子,被氧化,所以还原剂是Fe2+和S2O32-。
(2)根据氢原子守恒可知反应的化学方程式中x=4。
(3)反应中只有氧气中氧元素化合价降低,氧气是氧化剂,每生成1 mol Fe3O4,消耗1mol氧气,因此反应转移的电子为4mol。根据方程式可知3mol亚铁离子参加反应只有2mol被氧化,化合价从+2价升高到+3价,则根据电子得失守恒可知被Fe2+还原的O2的物质的量为2mol÷4=0.5mol。


科目:高中化学 来源: 题型:
【题目】如下左图所示,其中甲池的总反应式为2CH3OH+302+4KOH=2K2CO3+6H20,完成下列问题:

(1)甲池燃料电池的负极反应为___________________。
(2)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生____g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
(4)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2 的实验装置(如上右图)。若用于制漂白液,a 为电池的______极,电解质溶液最好用_____。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的1/3Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________________________。
当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___________________________ 。
c(Fe2+):c(Fe3+) | 沉淀性状 | 磁性大小 |
1:3 | 红棕色 | 92.7% |
1:2 | 棕色 | 96.5% |
2:1 | 黑色 | 100% |
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为________________________。
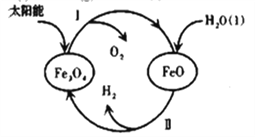
(3)已知:H2O(l)=H2(g)+1/2O2(g) △H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程Ⅰ的热化学方程式。
过程Ⅰ:________________________________,
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为:Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
①T℃时,10min内用Fe3O4表示的平均反应速率为_____g·min-1。
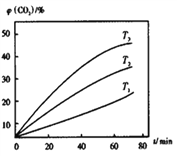
②其他条件不变时,该反应在不同温度下,CO2含量随时间的变化φ(CO2)-t曲线如图所示,温度T1、T2、T3由大到小的关系是_________________,判断依据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备,正丁烷(C4H10)催化脱氢制1-丁烯(C4H8) 的化学方程式如下:C4H10(g)=C4H8(g)+H2(g)△H,如图是该反应平衡转化率与反应温度及压强的关系图,下列说法正确的是
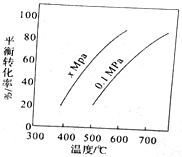
A. x>0.1
B. △H>O
C. 500C时,压强xMPa比0.1MPa条件下的平衡常数大
D. 一定温度下,在一恒容密闭容器中发生该反应,C4H10的浓度越高,平衡转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的下列各烃,完全燃烧后生成CO2最多的是____(填标号)
A.乙炔 B.乙烯 C.乙烷 D.甲烷
(2)某烃的一种同分异构体,核磁共振氢谱测得分子中只有一个吸收峰,则该烃的分子式可能为______(填标号)
A.C6H14 B.C7H16 C.C8H18 D.C9H20
(3)乙烯和丙烯属于同系物。下列叙述正确的是_____上(填标号)
A.等质量的乙烯和丙烯完全燃烧耗氧量相同
B.丙烯分子中三个碳原子处于同一直线上
C.乙烯和丙烯与HCl加成均有两种产物
D.以丙烯为单体加聚可以生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的说法中,正确的是( )
A.生物体中的化学元素在无机自然界中都可找到
B.在生物体内能找到无机自然界中的所有元素
C.各种元素在地壳中的含量都很丰富
D.不同生物体的元素种类差别很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 异丁烷和2-甲基丙烷是同种物质
B. H2与重氢互为同素异形体
C. 符合 CnH2n且n不同的烃一定属于同系物
D. 淀粉和纤维素分子式均为(C6H10O5)n,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽然很少,却是维持正常生命活动不可缺少的,可以通过下面的实例得到证明的是( )
A. Mg2+是叶绿素的组成成分
B. 油菜缺少B时只开花不结果
C. 动物血液中Ca盐含量太低,会抽搐
D. 缺P会影响ATP的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com