
【题目】已知:苯酚与Fe3+在溶液中存在可逆反应:Fe3+ + 6C6H5OH![]() H3Fe(OC6H5) 6 + 3H+,其中H3Fe(OC6H5) 6显紫色。实验如下:
H3Fe(OC6H5) 6 + 3H+,其中H3Fe(OC6H5) 6显紫色。实验如下:
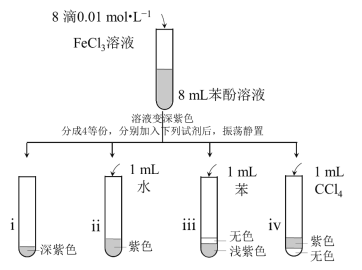
下列说法不正确的是:
A. i是空白对照实验
B. 向ii中滴加几滴浓盐酸,溶液颜色变浅
C. iii、iv中无色层中的溶剂分别为苯和CCl4
D. 苯酚在苯中的溶解性小于在CCl4中的溶解性
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气__ mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.6gFe和足量的盐酸完全反应失去电子数为0.3NA
B.常温常压下,100g质量分数为17%的H2O2溶液中含氧原子数目为NA
C.14g晶体硅中含0.5NA个原子
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)基态Ga原子中有_____种能量不同的电子,其价电子排布式为_________。
(2)第四周期的主族元素中,基态原子未成对电子数与镓相同的元素有_______(填元素符号)。
(3)三甲基镓[(CH3)3Ga]是制备有机镓化合物的中间体。
①在700℃时,(CH3)3Ga和AsH3反应得到GaAs,化学方程式为____________________。
②(CH3)3Ga中Ga原子的杂化方式为__________;AsH3的空间构型是________________。
(4)GaF3的熔点为1000℃,GaC13的熔点为77.9℃,其原因是_______________________。
(5)砷化镓是半导体材料,其晶胞结构如图所示。
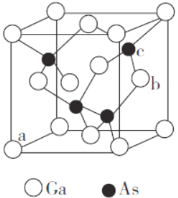
①晶胞中与Ga原子等距离且最近的As原子形成的空间构型为_______。
②原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中a(0,0,0)、b(1,![]() ),则c原子的坐标参数为______________。
),则c原子的坐标参数为______________。
③砷化镓的摩尔质量为M g·mol-1,Ga的原子半径为p nm,则晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是
A.通入少量HCl气体 B.加入少量NaOH固体
C.加入少量H2O D.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有:锰、铬、镉等重金属元素。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法为还原沉淀法,该法的工艺流程为:
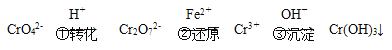
其中第①步存在平衡2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
(1)写出第①步反应的平衡常数表达式____________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要________ mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将下列物质与其对应的性质或用途连线。
物质与性质 | 物质与用途 |
SO2 黄色固体 NO2 黄绿色气体 Cl2 红棕色气体 S 无色气体 | 氨气 发酵粉 过氧化钠 漂白粉 碳酸氢钠 制冷剂 次氯酸钙 供氧剂 |
__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:
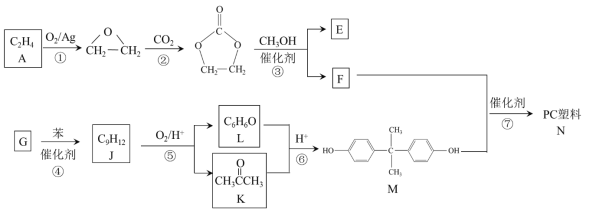
已知:
i.R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
ii.R1CH=CHR2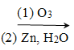 R1CHO + R2CHO
R1CHO + R2CHO
(1)A 中含有的官能团名称是______。
(2)①、②的反应类型分别是______、______。
(3)③的化学方程式是______。
(4)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是______。
(5)⑥中还有可能生成的有机物是______(写出一种结构简式即可)。
(6)⑦的化学方程式是______。
(7)己二醛是合成其他有机物的原料。L经过两步转化,可以制备己二醛。合成路线如下:

中间产物1的结构简式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NF3是微电子工业中常用的一种等离子蚀刻气体,具有较强的氧化性,工业生产NF3常用的方法有气一液反应法、气一固反应法和电解法等。
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____。部分键能数据如下表所示,△H3=_____kJ/mol。
化学键 | N-N | N=N | N | H-F | F-F | N-H | N-F |
键能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
反应I的平衡常数K1和反应II的平衡常数的关系是___。若在恒温、恒容的密闭容器中模拟气一固反应法(固体足量),起始时F2的浓度为5mol/L,反应过程中容器中压强一随时间变化曲线如图所示,则前2min的平均反应速率v(NF3)=___mol/(Lmin),该温度下K2=___。
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的____(填“正极”或“负极”),生成气体A的电极反应是____。
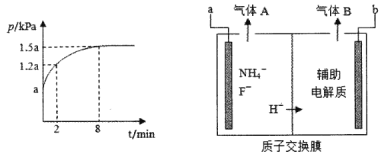
(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是_____。(用化学用语解释)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com