
【题目】利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
容器 | 温度/℃ | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | |||
n(CO2) | n(CH4) | n(CO) | n(H2) | n(H2) | ||
Ⅰ | T1 | 0 | 0.8 | 0.8 | 0.8 | 0.6 |
Ⅱ | T1 | 1.2 | 1.2 | 1.2 | 1.2 | / |
Ⅲ | T2 | 1.0 | 2.0 | 0 | 0 | 1.0 |
Ⅳ | T2 | 0.5 | 1.0 | 0 | 0 | / |
下列说法正确的是( )
A. T1>T2
B. 容器Ⅱ起始时的反应速率:v(正)>v(逆)
C. 容器Ⅰ、Ⅲ达到平衡时,容器内气体总压强之比:p(Ⅰ)∶p(Ⅲ) =11∶20
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小
【答案】AD
【解析】
A.反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),在2L容器内进行,计算KI
2CO(g)+2H2(g),在2L容器内进行,计算KI
T1n(开始)mol 0 0.8 0.8 0.8
n(变化)mol 0.1 0.1 0.2 0.2
n(平衡)mol 0.1 0.9 0.6 0.6
化学平衡常数K1=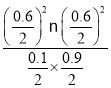 =0.36,
=0.36,
反应 CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),在2L容器内进行,计算KII
2CO(g)+2H2(g),在2L容器内进行,计算KII
T2n(开始)mol 1.0 2.0 0 0
n(变化)mol 0.5 0.5 1.0 1.0
n(平衡)mol 0.5 1.5 1.0 1.0
化学平衡常数KII=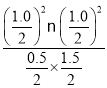 =0.33,K1>K2,由于该反应的正反应为吸热反应,根据平衡移动原理,升高温度,平衡向吸热的正反应方向移动,因此温度T1>T2,A正确;
=0.33,K1>K2,由于该反应的正反应为吸热反应,根据平衡移动原理,升高温度,平衡向吸热的正反应方向移动,因此温度T1>T2,A正确;
B.对于容器Ⅱ,Qc=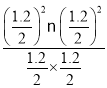 =0.36=K1,说明反应处于平衡状态,所以v(正)=v(逆),B错误;
=0.36=K1,说明反应处于平衡状态,所以v(正)=v(逆),B错误;
C.对于容器I,平衡时总物质的量n(总)=0.1mol+0.9mol+0.6mol+0.6mol=2.2mol;对于容器III,平衡时总物质的量n(总)=0.5mol+1.5mol+1.0mol+1.0mol=4.0mol,容器内气体的物质的量的比n(I):n(III)=2.2:4.0=11∶20,尽管反应容器的容积不变,但由于反应I、III反应温度不同,所以不能根据物质的量的比判断容器内气体的压强之比,C错误;
D.根据选项A分析可知容器III中CO2的转化率为(0.5÷1.0)×100%=50%;对于容器IV,反应温度与III相同,由于气体的物质的量减小,导致容器内气体压强减小,根据平衡移动原理,减小压强,平衡向气体体积扩大的正反应方向移动,使反应物CO2的转化率增大,因此容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小,D正确;
故合理选项是AD。


科目:高中化学 来源: 题型:
【题目】分别向体积均为100mL、浓度均为1mol/L的NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下图所示:
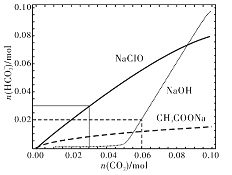
下列分析正确的是
A. CO2通入NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入CH3COONa溶液的反应:CO2+H2O+CH3COO-=HCO3-+CH3COOH
C. 通入n(CO2)=0.06mol时,NaOH溶液中的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.03mol时,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.03mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下溶度积常数:Ksp[Pb(OH)2]=2×10-15,Ksp[Fe(OH)2]=8×10-15。当溶液中金属离子浓度小于10-5molL-1视为沉淀完全。向20mL含0.10molL-1Ph2+和0.10molL-1Fe2+的混合溶液中滴加010amolL-1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示,则下列说法正确的是( )
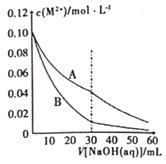
A. 曲线A表示![]() 的曲线
的曲线
B. 当溶液![]() 时,
时,![]() 开始沉淀,
开始沉淀,![]() 沉淀完全
沉淀完全
C. 滴入NaOH溶液体积大于30mL时,溶液中![]()
D. 室温下,滴加NaOH溶液过程中,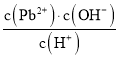 比值不断增大
比值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
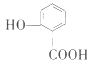
【题目】下面的排序不正确的是
A. 晶体的熔点:![]() >
>
B. 晶格能的大小: Al2O3>MgCl2>NaCl
C. 共价键的键长: F-F>C-Cl>C-S>Si-O
D. 硬度由大到小:金刚石>氮化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是
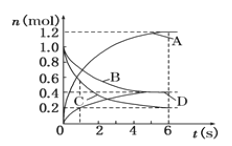
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1s时,v(A)=v(D)
C. 0~6s内,B的平均反应速率为0.05mol·L-1·s-1
D. 反应进行到6s时,B的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3+ + 3HCO3-= Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为:3H2+N2 ![]() 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是( )
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是( )
A. 3v(H2)正 = v(N2)逆 B. v(H2)生成= v(NH3)生成
C. v(N2)消耗 = 2v(NH3)消耗 D. 2v(H2)逆 = 3v(NH3)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业生产中常用纯碱溶液吸收排出的氮氧化物废气,废气中只含有NO、NO2两种气体。将一定量废气通入到足量的Na2CO3溶液中被完全吸收,溶液中生成的NO3-、NO2-两种离子的物质的量与废气中NO2的物质的量分数x![]() 变化关系可用图所示。已知溶液中可发生以下两个反应:
变化关系可用图所示。已知溶液中可发生以下两个反应:
①NO+NO2+Na2CO3=2NaNO2+CO2;
②2NO2+Na2CO3=NaNO2+NaNO3+CO2

下列说法正确的是
A.图中线段a表示NO3-离子
B.随x值增大,溶液中n(NO3-)+n(NO2-)增大
C.x=0.6时,反应中可收集到标准状况下CO2 44.8 L
D.若测得所得溶液中n(NO3-)为0.5 mol,则x值为0.75
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com