
【题目】下列离子方程式书写正确的是( )
A.FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B.醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C.在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO42-=BaSO4+2H2O
D.向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3+CO32-
科目:高中化学 来源: 题型:
【题目】(1)亚磷酸(H3PO3)为二元弱酸。 H3PO3中P元素的化合价为______,其在元素周期表的位置是__________,H3PO3与过量NaOH溶液反应的离子方程式为___________________。
(2)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示,化合物X可借助傅里叶红外光谱图确定。


①在图示的转化中,被还原的元素是_______________,X的化学式为________________。
②SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s) + 2B(g)![]() C(g) + D(g) 已达到平衡状态‘
C(g) + D(g) 已达到平衡状态‘
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:


为了研究X的结构,将化合物A在一定条件下水解只得到B(结构如图所示)和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应 C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________C______________ E _______________
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)反应①_____________________;反应⑥_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和 3molH2(g) | 1mol CH3OH (g)和 1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
请回答:
①a=_______________;
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___________。
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A.4.8gMg在足量的CO2中完全燃烧,转移电子数目为![]()
B.![]() 葡萄糖
葡萄糖![]() 含羟基
含羟基![]() 数目为
数目为![]()
C.常温常压下,![]() 和
和![]() 的混合气体含原子总数为
的混合气体含原子总数为![]()
D.10.0g质量分数为46%的酒精与足量的钠反应产生氢分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质检验是化学研究常用的方法之一。下列有关溶液成分的检验,结论不正确的是
A.若滴加酚酞溶液,溶液变红,原溶液不一定是碱溶液
B.若先滴加足量新制氯水,再滴加少量KSCN溶液,溶液变为血红色,则原溶液一定含有Fe2+
C.若滴加Na2CO3溶液,产生白色沉淀,则原溶液可能含有Ca2+
D.若滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原溶液中可能含CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
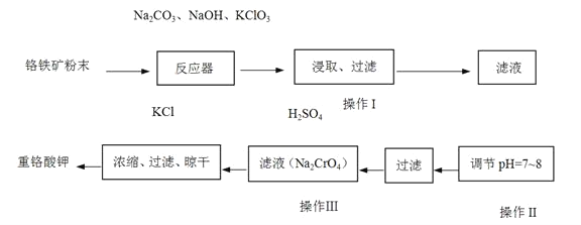
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
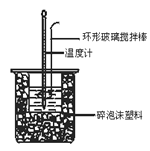
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com