
【题目】有关乙酸与甲酸甲酯的说法中不正确的是 ( )
A. 两者都可以和NaOH溶液反应 B. 可利用水将两者区分开
C. 两者互为同分异构体 D. 两者互为同系物
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
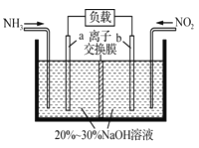
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
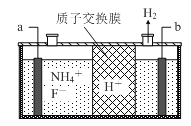
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气涉及下列装置中,其中正确的是( )
A.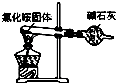
如图是氨气发生装置
B.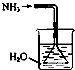
如图是氨气吸收装置
C.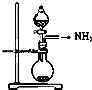
如图是氨气发生装置
D.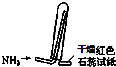
如图是氨气收集、检验装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日前正在研发的两种由电化学制取氨的装置如图1和图2所示:

下列说法正确的是
A. 工作时,O2-向X极移动,H+向Z极移动
B. 两个电解池的电解总反应方程式完全相同
C. 两个电解池生成相同量NH3时,电路中流过电子的物质的量相同
D. 随着反应的进行,两种电解池中电解质不断减少,需及时补充电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4(草酸)是一种无色晶体,易溶于水,熔点为182℃,150~160℃升华,189.5℃分解。25℃时,Ka1=6×10-2,Ka2=6.4×10-5,Ksp(CaC2O4)=4.0×10-9。某校甲、乙、丙3个学习小组设计实验探究草酸的化学性质。
(1)草酸中所含官能团的名称为__________;
反应Ca2+(aq)+H2C2O4(aq)![]() CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
(2)甲组同学在Na2CO3溶液中加入少量草酸溶液产生大量气体,他们查得H2CO3的Ka1=4.47×10-7,Ka2=4.68×10-11,则发生反应的离子方程式为______________。
(3)乙组同学在酸性KMnO4溶液中逐滴加入草酸溶液,溶液紫色逐渐褪去,说明草酸具有_____性,反应中氧化产物与还原产物的物质的量之比为_________。
(4)丙组同学设计下列装置分解H2C2O4并设计实验装置检验产物中的CO2和CO。
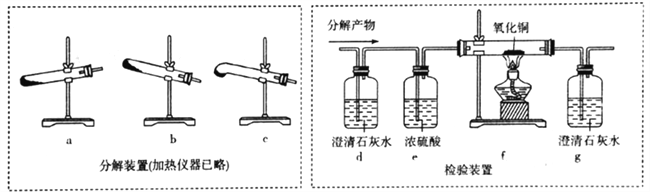 ①分解H2C2O4装置中最好的是__________(填字母)。
①分解H2C2O4装置中最好的是__________(填字母)。
②d中澄清石灰水变浑浊,能否说明有CO2生成? ___(填“能“或“不能”,下同),理由是________;仅依据装置g中澄清石灰水变浑浊,能否说明有CO生成?_________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据比较,前者比后者小的是
A.氯水与氨水中微粒种类B.乙烷与苯分子中碳碳键键长
C.氯化铯与氯化钠的熔点D.Al2O3与AlCl3的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案: 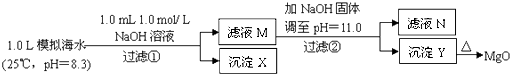
模拟海水中的 | Na+ | Mg2+ | Ca2+ | Cl﹣ | HCO3﹣ |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10﹣5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.已知:Ksp(CaCO3)=4.96×10﹣9;Ksp(MgCO3)=6.82×10﹣6;Ksp[Ca(OH)2]=4.68×10﹣6;Ksp[Mg(OH)2]=5.61×10﹣12 . 下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+ , 不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2gNaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有两种高聚物A、B,A能溶于苯、四氯化碳等有机溶剂,并加热到一定温度下熔融成粘稠状的液体,B不溶于任何溶剂,加热不会变软或熔融,则下列叙述中不正确的是( )。
A.高聚物A可能具有弹性,而高聚物B没有弹性
B.高聚物A一定是线型高分子材料
C.高聚物A一定是体型高分子材料
D.高聚物B一定是体型高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com