
【题目】H2C2O4(草酸)是一种无色晶体,易溶于水,熔点为182℃,150~160℃升华,189.5℃分解。25℃时,Ka1=6×10-2,Ka2=6.4×10-5,Ksp(CaC2O4)=4.0×10-9。某校甲、乙、丙3个学习小组设计实验探究草酸的化学性质。
(1)草酸中所含官能团的名称为__________;
反应Ca2+(aq)+H2C2O4(aq)![]() CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
(2)甲组同学在Na2CO3溶液中加入少量草酸溶液产生大量气体,他们查得H2CO3的Ka1=4.47×10-7,Ka2=4.68×10-11,则发生反应的离子方程式为______________。
(3)乙组同学在酸性KMnO4溶液中逐滴加入草酸溶液,溶液紫色逐渐褪去,说明草酸具有_____性,反应中氧化产物与还原产物的物质的量之比为_________。
(4)丙组同学设计下列装置分解H2C2O4并设计实验装置检验产物中的CO2和CO。
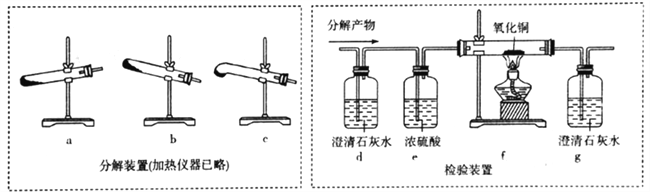 ①分解H2C2O4装置中最好的是__________(填字母)。
①分解H2C2O4装置中最好的是__________(填字母)。
②d中澄清石灰水变浑浊,能否说明有CO2生成? ___(填“能“或“不能”,下同),理由是________;仅依据装置g中澄清石灰水变浑浊,能否说明有CO生成?_________,理由是_____________。
【答案】 羧基 9.6×102 H2C2O4 +CO32-=CO2 ↑+C2O42- + H2O 还原 5:1 c 不能 H2C2O4 随产物进人装置d 会产生CaC2O4 沉淀 不能 无法证明从d逸出的气体中是否混有CO2
【解析】试题分析:(1)草酸的结构简式的HOOCCOOH;平衡常数K=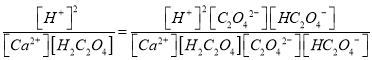 ;(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2;(3)KMnO4溶液具有强氧化性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度分析;②根据草酸易升华分析;没有验证从d逸出的气体中是否混有CO2;
;(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2;(3)KMnO4溶液具有强氧化性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度分析;②根据草酸易升华分析;没有验证从d逸出的气体中是否混有CO2;
解析:(1)草酸的结构简式的HOOCCOOH,含有的官能团是羧基;平衡常数K=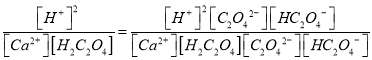 =
=![]() 9.6×102;(2)(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2,反应的离子方程式是H2C2O4+CO32-=CO2↑+C2O42-+H2O;(3)KMnO4溶液具有强氧化性,高锰酸钾溶液褪色说明高锰酸钾被还原,所以草酸具有还原性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O,CO2是氧化产物、MnSO4是还原产物,氧化产物与还原产物的物质的量之比为5:1;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度,所以分解H2C2O4装置中最好的是C;②根据草酸易升华,H2C2O4随产物进人装置d会产生CaC2O4沉淀,所以d中澄清石灰水变浑浊,不能说明有CO2生成;没有验证从d逸出的气体中是否混有CO2,所以仅依据装置g中澄清石灰水变浑浊,不能说明有CO生成;
9.6×102;(2)(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2,反应的离子方程式是H2C2O4+CO32-=CO2↑+C2O42-+H2O;(3)KMnO4溶液具有强氧化性,高锰酸钾溶液褪色说明高锰酸钾被还原,所以草酸具有还原性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O,CO2是氧化产物、MnSO4是还原产物,氧化产物与还原产物的物质的量之比为5:1;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度,所以分解H2C2O4装置中最好的是C;②根据草酸易升华,H2C2O4随产物进人装置d会产生CaC2O4沉淀,所以d中澄清石灰水变浑浊,不能说明有CO2生成;没有验证从d逸出的气体中是否混有CO2,所以仅依据装置g中澄清石灰水变浑浊,不能说明有CO生成;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】十九大报告中指出:“建设美丽中国,为人民创造良好生产生活环境,为全球生态安全作出贡献。”下列行为一般不会引起环境污染的是
A.冬季燃煤供暖B.废电池深埋降解
C.利用风能、太阳能发电D.节日燃放烟花爆竹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的![]()
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将![]() 与
与![]() 混合气体通过饱和食盐水可得到纯净的
混合气体通过饱和食盐水可得到纯净的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙酸与甲酸甲酯的说法中不正确的是 ( )
A. 两者都可以和NaOH溶液反应 B. 可利用水将两者区分开
C. 两者互为同分异构体 D. 两者互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
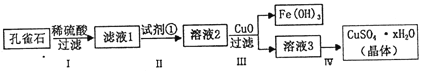
(1)步骤I中涉及的主要反应用离子方程式表示为___________.
(2)步骤Ⅱ中试剂①是_______(填代号).
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在____(填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______(计算结果精确到0.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COONH4显中性.
Ⅰ.将0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合(混合后溶液的体积变化忽略不计)测得混合溶液的pH=9.回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因: .
(2)混合溶液中c(CH3COOH)=mol/L(列式,不必化简).
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的顺序为:(填序号).
Ⅱ.Mg(OH)2沉淀可溶于NH4Cl溶液.同学们对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH﹣导致沉淀溶解;乙同学认为是NH4+与Mg(OH)2电离出的OH﹣反应生成弱电解质NH3H2O导致沉淀溶解.
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是:
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3H2O
(5)丙同学将所选试剂滴加到Mg(OH)2的悬浊液中,Mg(OH)2溶解,由此可知:(填“甲”或“乙”)的解释更为合理.Mg(OH)2沉淀与NH4Cl反应的离子方程式为: .
(6)现有Mg(OH)2和Al(OH)3沉淀的混合物,若要除去Al(OH)3得到纯净的Mg(OH)2 , 可用;若要除去Mg(OH)2得到纯净的Al(OH)3 , 可用;(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是①金属钠在纯氧中的燃烧产物,②在FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间,③向FeCl3溶液中滴入KSCN溶液,④无水硫酸铜溶解于水.( )
A. ③②①④ B. ②③①④ C. ③①②④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com