
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂:

对实验现象的“解释或结论”正确的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 氧化性:SO32-<I- |
B | b中无现象,加硫酸后产生淡黄色沉淀 | 硫酸将S2-氧化为硫单质 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | 亚硫酸钠溶液中存在水解平衡 |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. A B. B C. C D. D
【答案】C
【解析】Na2SO3溶液中亚硫酸钠具有还原性,可以和碘单质反应生成硫酸钠、碘化钠,亚硫酸钠做还原剂,碘化钠是还原产物,所以还原性:![]() ,A错误;Na2SO3溶液中硫元素是+4价,硫化钠中硫元素是-2价,二者可以和硫酸溶液发生氧化还原反应,硫元素归中到0价,即生成淡黄色硫单质沉淀,B错误; Na2SO3溶液中亚硫酸根离子水解显碱性,该溶液会使酚酞变红,加入氯化钡会结合亚硫酸根离子形成亚硫酸钡沉淀,水解平衡逆向进行,氢氧根离子浓度减小,碱性逐渐消失,所以红色褪去,C正确;亚硫酸钠具有还原性,加入盐酸酸化的硝酸钡,即相当于加入了硝酸,亚硫酸根离子能被硝酸氧化为硫酸根,硫酸根离子可以和钡离子反应生成硫酸钡沉淀,该沉淀不溶于硝酸,所以实验证明的是亚硫酸根离子的还原性,是被硝酸氧化的缘故,不能证明Na2SO3溶液已变质,D错误;正确选项C。
,A错误;Na2SO3溶液中硫元素是+4价,硫化钠中硫元素是-2价,二者可以和硫酸溶液发生氧化还原反应,硫元素归中到0价,即生成淡黄色硫单质沉淀,B错误; Na2SO3溶液中亚硫酸根离子水解显碱性,该溶液会使酚酞变红,加入氯化钡会结合亚硫酸根离子形成亚硫酸钡沉淀,水解平衡逆向进行,氢氧根离子浓度减小,碱性逐渐消失,所以红色褪去,C正确;亚硫酸钠具有还原性,加入盐酸酸化的硝酸钡,即相当于加入了硝酸,亚硫酸根离子能被硝酸氧化为硫酸根,硫酸根离子可以和钡离子反应生成硫酸钡沉淀,该沉淀不溶于硝酸,所以实验证明的是亚硫酸根离子的还原性,是被硝酸氧化的缘故,不能证明Na2SO3溶液已变质,D错误;正确选项C。


科目:高中化学 来源: 题型:
【题目】H2的燃烧热为286 kJ/mol,Li的燃烧热为299 kJ/mol。LiH可做飞船燃料,合成LiH的热化学方程式是2Li(s)+H2(g)=2LiH(s)△H=-182kJ/mol,则LiH的燃烧热为( )
A. 702 kJ/mol B. 442 kJ/mol C. 585 kJ/mol D. 351 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
(1)利用右图所示的装置完成方案一
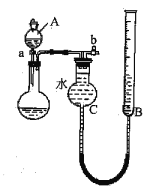
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
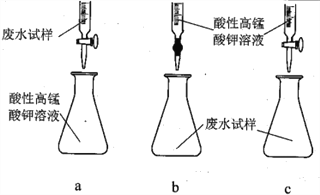
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023个NH3分子。则
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
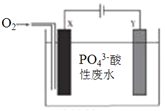
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++O2+4H++4PO43- =4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图a所示。在通常状况下,金刚石和石墨中,__________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__________。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式__________________________________________。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g) ![]() CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
则:2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l) △H=___________________。
CH3CH2OH(g)+3H2O(l) △H=___________________。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对上述流程的分析,下列说法正确的是_________。

A.该流程至少包含4种形式的能量转化
B.装置X中阴极反应为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图b为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

① E为该燃料电池的___________极(填“正”或“负”)。F电极上的电极反应式为___________。
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。

实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥环己烯;⑦聚丙烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是
A. ①③⑤ B. ④⑥⑦ C. ①④⑦ D. ②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com