
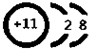 ,故答案为:第三周期第ⅥA族,
,故答案为:第三周期第ⅥA族,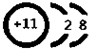 ;
;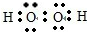 ,故答案为:
,故答案为: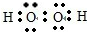 ;
; ,根据这个电子式可以看出这个离子带一个单位的正电荷,所以n为1,故答案为:
,根据这个电子式可以看出这个离子带一个单位的正电荷,所以n为1,故答案为:

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题:
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.蒸馏水 | B、.食盐水 |
| C、﹒氢氧化钠溶液 | D、.盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | B、2.5mol |
| C、4mol | D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/L氯化铵 |
| B、0.5mol/L氨水 |
| C、0.5mol/L H2SO4 |
| D、0.5mol/L盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com