
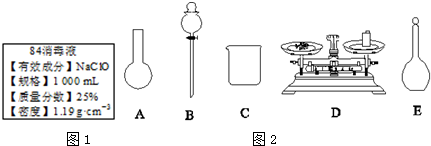
分析 (1)根据含25%NaClO、1000mL、密度1.19g•cm-3,结合c=$\frac{1000ρω}{M}$来计算;
(2)根据稀释前后溶质的物质的量不变来计算;
(3)根据溶液的配制及c=$\frac{n}{V}$、m=nM来分析;
(4)①根据c(H2SO4)=$\frac{1}{2}$c(H+)计算;
②根据溶液稀释前后溶质的物质的量不变计算.
解答 解:(1)c(NaClO)=c=$\frac{1000ρω}{M}$=$\frac{1000×1.1.9×25%}{74.5}$=4.0 mol•L-1,
故答案为:4.0;
(2)稀释后c(NaClO)=$\frac{1}{100}$×4.0 mol•L-1=0.04 mol•L-1,
故答案为:0.04;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol•L-1×74.5 g•mol-1=149 g,故D错误;
故答案为:C;
(4)①c(H2SO4)=2.3mol•L-1,则c(H+)=4.6mol•L-1,
故答案为:4.6;
②溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=$\frac{1000×1.84×98%}{98}$=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL,
故答案为:250.
点评 本题考查物质的量浓度的计算以及溶液的配制,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握相关计算公式的运用,难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列对于如图装置叙述正确的是

A. 若要除去CO中的CO2,可以装入氢氧化钠溶液,气体从b管进a管出
B. 该装置若装满水可以用于排水法收集气体
C. 该装置不可用于浓硫酸干燥H2气体
D. 用排水法收集气体时,气体从a管进b管出
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制100mL 1.0mol/LCuSO4溶液:将25g CuSO4•5H2O溶于100mL蒸馏水中 | |
| B. | 配制6mol/L100mL硫酸时,定容后应将容量瓶沿顺时针方向摇匀 | |
| C. | 盛放NaOH溶液时,使用带玻璃塞的磨口瓶 | |
| D. | 可以采用溶解、蒸发浓缩、冷却结晶、过滤的方法分离NaCl和KNO3固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取4.77g Na2CO3固体溶于水配成450mL溶液 | |
| B. | 称取5.3g Na2CO3固体溶于水配成500mL溶液 | |
| C. | 称取12.9g Na2CO3•10H2O 固体溶于水配成450mL溶液 | |
| D. | 量取90mL 0.5mol/L Na2CO3溶液加360mL水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解平衡的本质是结晶速率等于溶解速率 | |
| B. | 在不饱和溶液中,溶质的溶解速率小于结晶速率 | |
| C. | 在饱和溶液中,晶体的质量不改变,形状可能改变 | |
| D. | 当物质达到溶解平衡时,不改变外界条件,溶液的浓度也不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
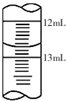 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
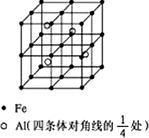 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com