
| A. | 配制100mL 1.0mol/LCuSO4溶液:将25g CuSO4•5H2O溶于100mL蒸馏水中 | |
| B. | 配制6mol/L100mL硫酸时,定容后应将容量瓶沿顺时针方向摇匀 | |
| C. | 盛放NaOH溶液时,使用带玻璃塞的磨口瓶 | |
| D. | 可以采用溶解、蒸发浓缩、冷却结晶、过滤的方法分离NaCl和KNO3固体混合物 |
分析 A、100mL水的体积不等于溶液的体积,不能用于计算;
B、配制6mol/L100mL硫酸时,定容后应将容量瓶上下颠倒而不是顺时针摇;
C、玻璃的主要成分有二氧化硅,氢氧化钠溶液与二氧化硅会反应生成硅酸钠粘合剂,将试剂瓶黏在一起不易打开;
D、KNO3和NaCl的溶解度受温度影响不同.
解答 A、配制100mL1.0mol/L CuSO4溶液,n(CuSO4)=0.1mol,m(CuSO4•5H2O)=0.1mol×250g/mol=25g,100mL水的体积不等于溶液的体积,不能用于计算,故A错误;
B、配制6mol/L100mL硫酸时,定容后应将容量瓶上下颠倒而不是顺时针摇,故B错误;
C、玻璃的主要成分有二氧化硅,氢氧化钠溶液与二氧化硅会反应生成硅酸钠粘合剂,将试剂瓶黏在一起不易打开,故C错误;
D、KNO3和NaCl的溶解度受温度影响不同,则用溶解、加热浓缩再冷却结晶的方法分离,故D正确,
故选:D.
点评 本题考查溶液的配制,试剂的存放,把握物质的性质、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意性质及性质差异,题目难度不大.


科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
在相同温度和相同压强下,决定气体体积的因素主要是
A.微粒本身的大小 B.微粒的数目 C.微粒间的距离 D.微粒的种类
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(OH-) | B. | c(NH4+)+c(NH3•H2O)=0.2 mol•L-1 | ||
| C. | c(NH3•H2O)>c(NH4+) | D. | c(NH4+)+c(H+)=0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加NaOH | B. | 加HCl | C. | 加NH4Cl | D. | 加同浓度的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视液面 | B. | 容量瓶洗净后有少量水残留 | ||
| C. | 转移时没有洗涤烧杯和玻璃 | D. | 所用的氢氧化钠已吸水潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
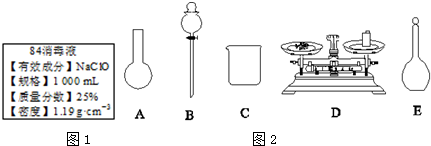
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
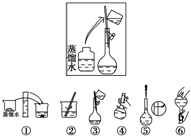 某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )
某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )| A. | ①与②之间 | B. | ②与③之间 | C. | ④与⑤之间 | D. | ⑤与⑥之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com