
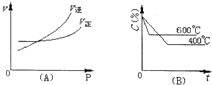
 如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、N2O3(g)?NO2(g)+NO(g)△H>0 |
| B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、3NO2(g)+H2O(I)?2HNO3(I)+NO(g)△H<0 |
| D、CO2(g)+C(s)?2CO(g)△H>0 |


科目:高中化学 来源: 题型:
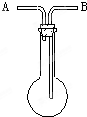 洗气瓶用途的延伸:利用如图所示的装置收集以下8种气体:
洗气瓶用途的延伸:利用如图所示的装置收集以下8种气体:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氟酸保存在密封的玻璃瓶中 |
| B、少量金属钠保存在煤油中 |
| C、硅酸钠保存在带橡皮塞的试剂瓶中 |
| D、氢氧化钠溶液保存在带橡皮塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol.L-1氢氯酸(HCN)的pH约为3 |
| B、常温下,pH=4的氢氯酸稀释100倍后所得溶液pH<6 |
| C、10mL 1 mol.L-1氢氯酸(HCN)恰好与10mL 1 mol.L-1NaOH溶液完全反应 |
| D、常温下,0.1mol.L-1NaCN溶液的pH约为10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度和减小压强 |
| B、降低温度和减小压强 |
| C、降低温度和增大压强 |
| D、升高温度和增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡有杂质的铜片放在稀硫酸中,较长时间后发现溶液变蓝色,说明Cu片发生了吸氧腐蚀 |
| B、反应H2S+H2SO4(浓)═S↓+SO2↑+2H2O中,生成物S是还原产物. |
| C、元素的非金属性强弱与其氢化物水溶液的酸性强弱相一致 |
| D、已知:P4(s)+6Cl2═4PCl3(g)△H=a KJ?mol-1 P4(s)+10Cl2(g)=4PCl5(g)△H=bKJ?mol-1 由此可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL2mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制氢气时,改用铁片和浓硫酸反应可增大反应物浓度,所以可以加快产生氢气的速率 |
| C、二氧化硫的催化氧化是一个放热反应,升高温度,反应活化能降低,反应速率加快 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,活化分子百分数不变,反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com