
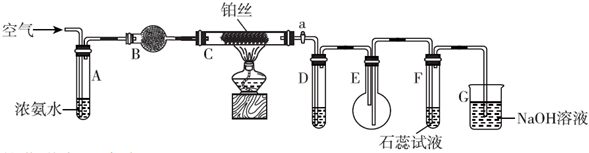
分析 装置分析先通入空气,通过浓氨水带出氨气,通过装置B干燥后,在装置C中氨气和氧气催化剂铂丝作用下加热反应生成一氧化氮和水,通过装置D中 的浓硫酸干燥吸收氨气和水蒸气,在装置E中观察到红棕色气体二氧化氮生成,通入石蕊试液溶液变红色,剩余污染性气体用氢氧化钠溶液吸收,
(1)氨气的催化氧化反应生成一氧化氮和水;
(2)该反应为放热,故不加热后仍能保持红热状态;
(3)产物中有NO和NH3,NO会被O2氧化生成NO2,在于空气中的水蒸气反应生成HNO3,而HNO3与NH3会产生白烟;
(4)Ksp=c(Al3+)•c(OH-)3,离子浓度小于10-5 mol?L-1时,可以认为沉淀基本完全.
解答 解:(1)NH3和O2氧化生成NO和H2O,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)加热玻璃管C一段时间后,打入空气,观察到C中物质呈红热状态;停止加热后仍能保持红热,说明该反应为放热,故不加热后仍能保持红热状态
故答案为:放热;
(3)分析可知铵的催化氧化生成一氧化氮和水蒸气,同时含有氨气和氧气,通过装置D中 的浓硫酸除去水蒸气和氨气,得到 一氧化氮和氧气反应生成红棕色气体二氧化碳,若取消D,一氧化氮和氧气反应生成的二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵固体,所以在E中仅观察到大量白烟,
故答案为:浓H2SO4,生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成NH4NO3;
(4)Ksp=c(Al3+)•c(OH-)3,离子浓度小于10-5 mol?L-1时,可以认为沉淀基本完全,在pH=8的氨水中,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,可以存在的Al3+的浓度=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{1{0}^{-36}}{(1{0}^{-6})^{3}}$=1.0×10-18,在pH=3的溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11mol/L,可以存在的Al3+的浓度=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{1{0}^{-36}}{(1{0}^{-11})^{3}}$=10-3 mol?L-1,所以不能完全沉淀,
故答案为:1.0×10-18,不能;
点评 本题考查了氨气、一氧化氮、二氧化氮、硝酸等物质的性质分析,沉淀溶解平衡中溶度积常数的计算应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 二氧化碳能灭火,所以燃着的镁条在二氧化碳中便熄灭 | |
| B. | 硬铝的硬度比铝大,熔点比铝低 | |
| C. | 相同质量的铜分别跟足量的浓硝酸或稀硝酸反应,产生气体的体积比为1:1 | |
| D. | 相同质量的铝分别跟足量的稀盐酸酸或氢氧化钠溶液共热,产生气体体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑧ | B. | ③④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ①②④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| B. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 | |
| C. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 多年来我国广大农村生火做饭使用的都是化石燃料 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com