
����Ŀ�������й�ͼ���˵����ȷ����
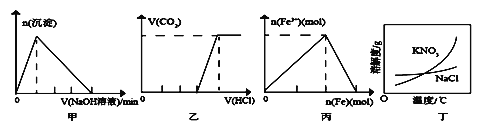
A. ͼ�ױ�ʾ����ij������Һ����μ���NaOH��Һ�����������ɳ��������ʵ�����μ�NaOH��Һ����Ĺ�ϵ
B. ͼ�ұ�ʾ�������ʵ�����NaOH��Na2CO3�Ļ����Һ����μ���ϡ��������������������������μ�HCl��Һ����Ĺ�ϵ
C. ͼ����ʾ����ϡ������Һ��������������������Һ��Fe3�����ʵ����������������ʵ����ı仯��ϵ
D. ��ȥ������������������Ȼ��ƿ��á�����Ũ�������ȹ��ˡ��ķ���
���𰸡�C
��������
A.��ij������Һ�еμ�NaOH ��Һֱ����������Һ�������ɳ�����Ȼ����������ܽ⣬ǰ�������ηֱ����ĵ�����������Һ�����֮��Ϊ3:1��ͼ����֮��������A����B.����NaOH��Na2CO3�ֱ�Ϊ1mol������1molNaOH��Na2CO3�Ļ����Һ�еμӹ�����ϡ���ᣬ���������������ᷴӦ����1molHCl��̼���������ᷴӦ����1molNaHCO3������HCl 1mol�����1molNaHCO3�������ᷴӦ����������̼���壬������HCl 1mol�� ���Բ�������ǰ��������������֮��Ϊ2:1��ͼ����֮��������B����C.��ϡ������Һ�м������ۣ��ȷ���Fe+2NO3-+4H+=Fe3++2NO��+2H2O�� ������������֮�������ӵ����ﵽ���ֵ�������������ۺ�����������������Ӧ��Fe+2Fe3+=3Fe2+�������ӵ�����Сֱ��Ϊ0������������Ӧ����������Ϊ1��0. 5=2��1����ͼ������ϣ�C��ȷ��D. KNO3�ܽ�����¶ȱ仯�ϴ��Ȼ����ܽ�����¶ȱ仯������˳�ȥ����KNO3��������NaC1���á�����Ũ������ȴ�ᾧ�����ˡ��ķ������з��룬��D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮϡ��0.1mol/L��ˮʱ����Һ������ˮ�������Ӷ���С����
A. ![]() B.
B. ![]() C. c(H+)��c(OH��)�ij˻�D. OH�������ʵ���
C. c(H+)��c(OH��)�ij˻�D. OH�������ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��Mg������ŨNH4Cl��Һ�в�����ɫ���壬��������________(�ѧʽ)���������ӷ���ʽ�������������ԭ��________________��
(2)Mg(OH)2��Һ�д���Mg(OH)2�ij����ܽ�ƽ�⣬�ɱ�ʾΪ(�����ӷ���ʽ��ʾ)____________���������Һ�м���Ũ��NH4Cl��Һ���۲쵽��������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֧�ź�����ͷ�����ĸֹ���������ӵ������������������з���������ԭ����ͼ��ʾ�����и߹�����Ϊ���Ը��������������йر�������ȷ����
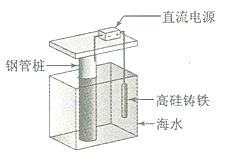
A. ͨ�뱣������ʹ�ֹ����港ʴ�����ӽ�����
B. ͨ������·���ӱ�ǿ�ƴӸ߹���������ֹ�
C. �߹���������������Ϊ����������Ϻʹ��ݵ���
D. ͨ��ı�������Ӧ�ø��ݻ��������仯���е���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˼ά�ǻ�ѧ�����г��õ�һ��˼ά�����������йط�Ӧ����ʽ��������ȷ����
��֪ | ���� | |
A | ��Fe����CuSO4��Һ��Fe��Cu2��===Cu��Fe2�� | ��Na���뵽CuSO4��Һ��2Na��Cu2��===Cu��2Na�� |
B | ϡ������Ba(OH)2��Һ��Ӧ��������2H����SO42-��Ba2����2OH��===BaSO4����2H2O | NaHSO4��Һ��Ba(OH)2��Һ��Ӧ������2H����SO42-��Ba2����2OH��===BaSO4����2H2O |
C | ����������Ӧ2Fe��3Cl2 | ���͵ⵥ�ʷ�Ӧ2Fe��3I2 |
D | ��Ca(ClO)2��Һ��ͨ������CO2��Ca2����2ClO����CO2��H2O===CaCO3����2HClO | ��Ca(ClO)2��Һ��ͨ������SO2��Ca2����2ClO����SO2��H2O===CaSO3����2HClO |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������ˮ�еμ�NaOH��Һ����Һ��ˮ�����![]() ��NaOH��Һ���֮��Ĺ�ϵ����ͼ��ʾ�������ƶ���ȷ���ǣ� ��
��NaOH��Һ���֮��Ĺ�ϵ����ͼ��ʾ�������ƶ���ȷ���ǣ� ��
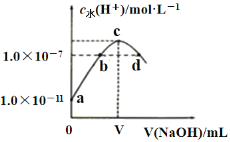
A. ��pH��ֽ�ⶨa���Ӧ��Һ����![]()
B. b��d���Ӧ����Һ�ж����ڣ�![]()
C. c���Ӧ����Һ�У�![]()
D. �����¼�ˮϡ��d���Ӧ����Һ����Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ʾ��ȷ���� (����)
A. ��FeI2��Һ��ͨ�����������Cl2��2I ��=2Cl����2I2
B. ͭ��ϡ���ᷴӦ��3Cu��4H����2NO3��=3Cu2����2NO����2H2O
C. ����ʯ���ڴ����У�CaCO3��2H��=Ca2����H2O��CO2��
D. ��FeCl3����ˮ���ɽ��壺Fe3����3H2O![]() Fe(OH)3(����)��3H��
Fe(OH)3(����)��3H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ұ���������ȡ����ϩ�ķ�Ӧ���£�
![]() ��g��
��g��![]() ��g����H2��g��
��g����H2��g��
�ֽ�x mol�ұ�����ͨ������ɱ���ܱ������з�Ӧ��ά����ϵ��ѹǿp���㶨����ij���������£��ұ���ƽ��ת�������¶ȱ仯��ͼ��ʾ��

��֪�������ѹ��p������ ������ѹ��p��������������������Ǹ���Ӧ������˵����ȷ����
A��400��ʱ������ϵ��ͨ��ˮ������v��������v������ ����С�����ұ�ת���ʽ���
B��500��ʱ������ϵ��ͨ���ұ�������ϩ��������0.1x mol��ƽ�����ƶ�
C��550��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp��![]() �� p��
�� p��
D��550��ʱƽ����ϵ�б���ϩ�����������450��ʱ��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ѹǿ�£�����ͬ������CH4��CO2��O2��SO2��������ֱ��ĸ������С��ͬ����������˵������ȷ����

A. ����B��װ����O2B. ����A������D���������ʵ���֮��Ϊ4��1
C. ����A������C��������������D. ����C������D�������ܶ�֮��Ϊ2��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com