
【题目】分类是科学研究的重要方法,下列物质分类正确的是( )
A. 非电解质:乙醇、氯气B. 酸性氧化物:NO、![]()
C. 胶体:豆浆、葡萄糖溶液D. 离子化合物:NaH、![]()
【答案】D
【解析】
A、在水溶液里和熔融状态下都不导电的化合物是非电解质;
B、酸性氧化物是与碱反应生成盐和水的氧化物;
C、分散质粒子直径在1nm—100nm之间的分散系;
D、活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。
A、氯气是单质不是电解质也不是非电解质,故A错误;
B、NO不是酸性氧化物,是不成盐氧化物,故B错误;
C、葡萄糖是小分子,其溶液不是胶体,故C错误;
D、NaH是离子化合物,其中阳离子为![]() ,阴离子为
,阴离子为![]() ,铵盐是离子化合物,故D正确。
,铵盐是离子化合物,故D正确。
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用圆表示 3 种物质之间的关系(见如图),其中Ⅰ为大圆,Ⅱ和Ⅲ是包含在大圆之内 的 2 个小圆。符合其关系的是( )
Ⅰ | Ⅱ | Ⅲ | |
A | 脱氧核糖核酸 | 核糖核酸 | 核酸 |
B | 染色体 | DNA | 脱氧核糖 |
C | 固醇 | 胆固醇 | 维生素 D |
D | 蛋白质 | 酶 | 性激素 |
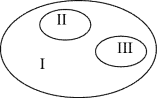
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某气态混合烃,完全燃烧生成13.2gCO2和4.5g H2O,则下列符合此条件的混合烃选项为
A. C2H4和C4H6B. C2H2和C4H4C. C2H2和C3H8D. C2H4和C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
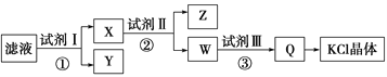
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_______。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是____________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。
注意事项:
1、本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2、密封保存,请勿与洁厕灵同时使用。
3、保质期为一年。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/( mol·L1) | 0.1 | 0.2 | 0 |
平衡浓度/( mol·L1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期主族元素,且原子序数依次增大。已知X的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的最外层电子数是W原子最外层电子数的2倍,Z原子最外层只有1个电子。下列说法正确的是( )
A. 离子半径:![]() B. Z和Y形成的化合物可能含有非极性键
B. Z和Y形成的化合物可能含有非极性键
C. 氢化物的稳定性:![]() D. 最高价氧化物对应水化物的碱性:
D. 最高价氧化物对应水化物的碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)柠檬 酸是 一种 重 要的 有 机 酸 ,其结构简式 为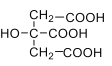 , 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题:
, 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题:
①设计实验证明柠檬酸的酸性比碳酸强:___。
②设计实验证明柠檬酸为三元酸:___。
(2)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示。
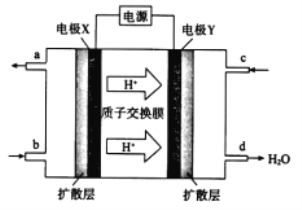
①氧气应从 c 处通入,则电极 Y 上发生反应的电极反应式为___。
②二甲醚(CH3OCH 3 )应从 b 处通入,则电极 X上发生反应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置可以测定混合气体中ClO2的含量:
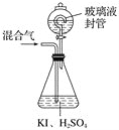
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
(1)锥形瓶内ClO2与碘化钾反应的离子方程式为____________________________。
(2)玻璃液封装置的作用是_______________________。
(3)V中加入的指示剂通常为_____,滴定至终点的现象是_______。
(4)测得混合气中ClO2的质量为________ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com