
【题目】(1)柠檬 酸是 一种 重 要的 有 机 酸 ,其结构简式 为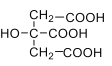 , 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题:
, 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题:
①设计实验证明柠檬酸的酸性比碳酸强:___。
②设计实验证明柠檬酸为三元酸:___。
(2)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示。
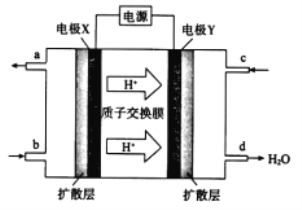
①氧气应从 c 处通入,则电极 Y 上发生反应的电极反应式为___。
②二甲醚(CH3OCH 3 )应从 b 处通入,则电极 X上发生反应的电极反应式为___。
【答案】向盛有少量NaHCO3溶液的试管里滴加柠檬酸溶液,有气泡产生(或其他合理设计) 用NaOH标有溶液滴定柠檬酸溶液,消耗NaOH的物质的量是柠檬酸的3倍 O2+4e﹣+4H+═2H2O (CH3)2O﹣12e﹣+3H2O=2CO2+12H+
【解析】
(1)①要证明柠檬酸的酸性比碳酸强,可以利用强酸制取弱酸分析;
②利用酸碱中和滴定酸碱物质的量比确定柠檬酸是三元酸;
(2)根据氢离子移动方向知,Y为原电池正极,X为负极,则c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e-+4H+═2H2O,电解质溶液为酸性溶液,b处通入的物质是二甲醚,X电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,据此分析解答。
(1)①要证明柠檬酸的酸性比碳酸强,可以利用强酸制取弱酸,向盛有少量NaHCO3的试管里滴加柠檬酸溶液,有气泡产生就说明柠檬酸酸性大于碳酸,
因此,本题正确答案是:向盛有少量NaHCO3溶液的试管里滴加柠檬酸溶液,有气泡产生(或其他合理设计);
②柠檬酸和NaOH发生中和反应时,如果柠檬酸是三元酸,则参加反应的NaOH物质的量应该是柠檬酸的三倍,所以用NaOH标准溶液滴定柠檬酸溶液,消耗NaOH的物质的量是柠檬酸的3倍就说明柠檬酸是三元酸,
因此,本题正确答案是:用NaOH标有溶液滴定柠檬酸溶液,消耗NaOH的物质的量是柠檬酸的3倍;
(2)①c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e-+4H+═2H2O,因此,本题正确答案是:O2+4e-+4H+═2H2O;
②b处通入的物质是二甲醚,X电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,
因此,本题正确答案是:(CH3)2O-12e-+3H2O=2CO2+12H+。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是科学研究的重要方法,下列物质分类正确的是( )
A. 非电解质:乙醇、氯气B. 酸性氧化物:NO、![]()
C. 胶体:豆浆、葡萄糖溶液D. 离子化合物:NaH、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含![]() 、FeO,杂质为
、FeO,杂质为![]() 和
和![]() 等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)FeOOH中Fe元素的化合价为____。
(2)“酸溶”时,所选择的硫酸为溶质质量分数49%,密度![]() ,该硫酸物质的量浓度是___
,该硫酸物质的量浓度是___![]() ,
,![]() 反应的离子方程式为____。
反应的离子方程式为____。
(3)滤渣Ⅰ的主要成分是![]() 和___(填化学式);
和___(填化学式);![]() 被
被![]() 还原的离子方程式为_____。
还原的离子方程式为_____。
(4)“氧化”中,需检验溶液中的离子是否氧化完全,所选用的试剂是____。
(5)滤液Ⅱ中溶质是___(填化学式);洗涤固体的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类文明进步息息相关,下列说法错误的是( )
A. 蚕丝的主要成分是蛋白质,属于天然高分子材料
B. 汉代烧制出“明如镜、声如磬”的瓷器,主要化学成分是硅酸盐
C. 2022年冬奥会聚氨酯速滑服,是无机非金属材料
D. 城市公交系统推广的清洁燃料压缩天然气“![]() ”、液化石油气“
”、液化石油气“![]() ”,主要成分都是烃
”,主要成分都是烃
查看答案和解析>>
科目:高中化学 来源: 题型:
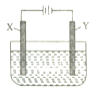
【题目】(1)电解原理具有广泛应用,如图为在铁上镀铜的简易装置示意图,则X极材料为___, 电极反应式为___;电解质溶液为___。
(2)燃料电池是一种将燃料所具有的化学能直接转化成电能的装置。
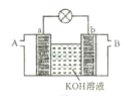
①以多孔铂为电极,如图装置中 A、B 口分别通入CH3 CH2OH和O2构成燃料电池模型,该电池负极的电极反应式为___。
②科学家研究了转化温室气体的方法,利用如图所示装置可以将CO2 转化为气体燃料CO,该电池正极的电极反应式为___。
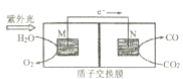
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
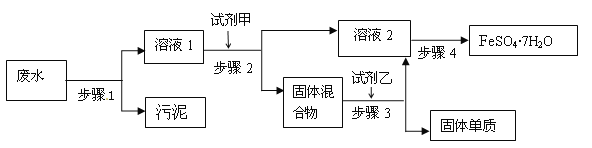
(1)步骤1的主要操作是___,需用到的玻璃仪器除烧杯外还有___。
(2)固体混合物是____(填化学式)
(3)步骤3中发生反应的化学方程式为___。
(4)步骤4中涉及的操作是:蒸发浓缩、___、过滤、洗涤、干燥。
(5)火法制得的粗铜中常混有少量氧化亚铜(Cu2O),氧化亚铜溶于稀硫酸溶液变蓝。试写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌—碘溴液流电池,其工作原理如图所示。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )

A. 放电时,a电极反应为I2Br-+2e-=2I-+Br-
B. 充电时,b电极每增重0.65g,溶液中有0.01mol I-被氧化
C. 放电时,溶液中离子的数目增大
D. 充电时,a电极接外电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上被称为“世界八大公害”和“20 世纪十大环境公害”之一的洛杉矶光化学烟雾事件使 人们深刻认识到了汽车尾气的危害性。汽车尾气中氮氧化物和碳氢化合物受紫外线作用可产 生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )
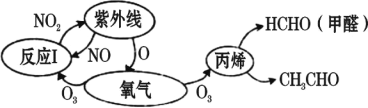
A.烟雾是一种固溶胶,其分散剂是空气B.O2 和 O3 是氧的两种同素异形体
C.反应 I 属于氧化还原反应D.NO2 不是酸性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com