
����Ŀ��ijͬѧ���ù�ҵ����ʯ(��������SiO2��Al2O3��Fe2O3������)��ȡCaCl2��6H2O��������������̣�
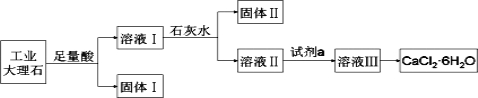
����˵������ȷ����( )
A�����������SiO2�����������Fe(OH)3
B��ʹ��ʯ��ˮʱ��Ҫ����pH����ֹ��������Al(OH)3ת��ΪAlO2��
C������Һ���õ�CaCl2��6H2O��Ʒ�Ĺ����У�����ƺ�������ֹ����ֽ�
D�����ı�ʵ�鷽��������Һ����ֱ�ӼӰ�ˮ��������ȫ����ȥ����������Һ������Ũ������ȴ�ᾧҲ�ɵõ�����CaCl2��6H2O
���𰸡�D
��������
�����������ҵ����ʯ(��������SiO2��Al2O3��Fe2O3������)�����������ᣬ�õ���������������Ȼ��ơ��Ȼ������Ȼ��������Һ�����Թ������к���SiO2����Һ�м�ʯ��ˮ������pH�����Եõ�Al(OH)3��Fe(OH)3��������Ϊ�����������ˣ�����Һ�������и��������������ƣ����Ȼ�����Һ��CaCl26H2O�ֽ⣬���Դ���Һ�л���Ȼ��ƾ���ʱ��Ҫ��ֹ��ֽ⡣A����������ķ�����֪���������к���SiO2���������к���Fe(OH)3����A��ȷ��B�����������������ԣ�����������������Һ������AlO2-����B��ȷ��C��CaCl26H2O�ֽ⣬���Դ���Һ�л���Ȼ��ƾ���ʱ��Ҫ��ֹ��ֽ⣬��C��ȷ��D�����ı�ʵ�鷽��������Һ����ֱ�ӼӰ�ˮ��������ȫ����ȥ����������Һ�к����Ȼ�泥�������Ũ������ȴ�ᾧ�õ���CaCl26H2O��������D����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�п���˵��SO2����Ư���Ե���
A��SO2ͨ��������������Һ����ɫ��ȥ
B��SO2ͨ��Ʒ����Һ�к�ɫ��ȥ
C��SO2ͨ����ˮ��Һ�к���ɫ��ȥ
D��SO2ͨ�������������̪�Ļ����Һ�к�ɫ��ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL14.0 mol��L-1Ũ�����м���������ͭ����ַ�Ӧ���ռ�����״����2.24L NO��NO2���������������NO2��N2O4���ת��������μӷ�Ӧ��ͭ������Ϊ�� ��
A��6.4g B��12.8g C��19.2g D��38.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼI��NO2(g)+CO(g)![]() CO2(g)+N0(g)��Ӧ�����������仯ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X,Y��X����ı仯��ϵ������ͼII��ʾ�������й�˵����ȷ����
CO2(g)+N0(g)��Ӧ�����������仯ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X,Y��X����ı仯��ϵ������ͼII��ʾ�������й�˵����ȷ����
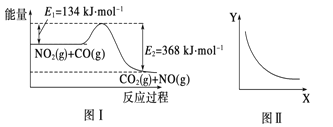
A. �÷�Ӧ���ʱ� ��H=��234kJ/mol
B. ��X��ʾ�¶ȣ���Y��ʾ�Ŀ�����CO2�����ʵ���Ũ��
C. ��X��ʾCO����ʼŨ�ȣ���Y��ʾ�Ŀ�����NO2��ת����
D. ��X��ʾ��Ӧʱ�䣬��Y��ʾ�Ŀ����ǻ��������ܶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£������ΪV L��Բ����ƿ�г��������������ں�������ˮ��ˮ��������ͼ��ʾ����ʵ����Ϻ���������ƿ��ˮ����ȡ������NH3H2O��NH4+��NH3��ɢ��ˮ��������������Һ���ܶ�Ϊ��gcm��3������˵����ȷ������ ��
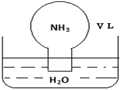
A���������㣬���ܼ���������Һ�����ʵ���Ũ��
B��������Һ����n��NH3H2O��+n��NH4+��+n��NH3��=![]() mol
mol
C��������Һ����������Ϊ![]() ��
��
D��ˮ���ղ����ܳ���������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ú���Al2O3��SiO2������FeO��xFe2O3�������Ʊ�Al2(SO4)3��18H2O��������������(���ֲ�����������)��
�����������м������ϡH2SO4�����ˣ�
��������Һ�м������KMnO4��Һ��������Һ��pHԼΪ3��
�������ȣ�����������ɫ���������ã��ϲ���Һ���Ϻ�ɫ��
��������MnSO4���Ϻ�ɫ��ʧ�����ˣ�
����.�پ���һϵ�в���������õ���Ʒ��
(1)�������й�������������Ҫ�ɷ�Ϊ��______________________��
H2SO4�ܽ�Al2O3�����ӷ���ʽΪ��_____________________��
(2)�������м���KMnO4ʱ������Ӧ�����ӷ���ʽΪ�� ��
(3)��֪�������������������pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
��ʼ����ʱ | 3.4 | 6.3 | 1.5 |
��ȫ����ʱ | 4.7 | 8.3 | 2.8 |
ע���������ӵ���ʼŨ�Ⱦ�Ϊ0.1 mol��L��1
�����ݱ������ݽ��Ͳ�������Ŀ�ģ�________________________��
����Al3+��ʼ����ʱ��Fe3+��Ũ��ԼΪ��_______________________��
(4)��֪��һ�������£�MnO![]() ����Mn2����Ӧ����MnO2��
����Mn2����Ӧ����MnO2��
�������ij����м���Ũ���Ტ���ȣ���˵�������д���MnO2�������ǣ� ��
���������м���MnSO4��Ŀ���ǣ� ��
(5)����������һϵ�в�������__________________��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л��������;������ȷ����
A. ����ͨ��ʹ�õĹ��µ���Ҫ�ɷ��Ǿ���Si��̫���ܵ��ʹ�õIJĖ���Ҫ��SiO2
B. ˮ����������������������
C. ���������Һ���ƾ���˫��ˮ����ɱ������������ԭ����ͬ����������ǿ������
D. SO2������Ư��ֽ����ë��˿����ñ�衢����ʳƷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ԭ�ӵ��ӻ�������ͺͷ��Ӽ��ι�������ȷ���ǣ� ��
A��CCl4��Cԭ��sp3�ӻ���Ϊ����������
B��BF3��Bԭ��sp2�ӻ���Ϊƽ��������
C��CS2��Cԭ��sp���ӻ���Ϊֱ����
D��H2S�����У�SΪsp���ӻ���Ϊֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӷ�Ӧ��ij��ҵ��ˮ�н����±������е�5��(������ˮ�ĵ��뼰���ӵ�ˮ��)���Ҹ������ӵ����ʵ���Ũ���������Ϊ0.1mol/L��
������ | K�� Cu2�� Fe3�� Al3�� Fe2�� |
������ | Cl�� |
��ͬѧ��̽����ˮ����ɣ�����������ʵ�飺
�����ò�˿պȡ������Һ���ڻ��������գ�����ɫ����(����ɫ�ܲ����۲�)��
����ȡ������Һ������KSCN��Һ�����Ա仯��
������ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����ʱ��Һ��Ȼ���壬����Һ��������������ԭ��Һ��������ͬ��
�������������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɡ�
���ƶϣ�
��1�� �����������жϣ���Һ��һ�������е���������___________(д���ӷ���)
��2�� ���м�����������������ɫ����ĵ����ӷ���ʽ��______________________
��3�� ���������ú���ɫ����ͨ��ˮ�У��������ɫ���������Ļ�ѧ����ʽΪ____________
��4�� ��ͬѧ����ȷ��ԭ��Һ��������������___________����������______________(д
���ӷ���)
��5�� ��ҵ��ˮ�г����в�ͬ���͵���Ⱦ��ɲ��ò�ͬ�ķ�����������������ͬѧ��Ժ�
��ͬ��Ⱦ��ķ�ˮ����Ĵ�����ʩ�ͷ�����������ȷ����__________________��
ѡ�� | ��Ⱦ�� | ������ʩ | ������� |
A | ���� | ����ʯ���к� | ������ |
B | Cu2�����ؽ������� | �������γ��� | ��ѧ�� |
C | �������л���ķ�ˮ | ͨ�������л | ������ |
D | ���Եķ�ˮ | td style="width:106.85pt; border-top-style:solid; border-top-width:0.75pt; border-right-style:solid; border-right-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding-right:5.03pt; padding-left:5.03pt; vertical-align:middle">��ѧ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com