
| A. | 制取一氧化氮 | B. | 制取乙烯 | C. | 制取乙炔 | D. | 氢气还原氧化铜 |
分析 A.铜与稀硝酸在常温下反应生成一氧化氮,一氧化氮不溶于水,可以用排水法收集;
B.制取乙烯是用乙醇在浓硫酸加热到170度条件下反应;
C.制取乙炔是将饱和食盐水加入到电石上;
D.氢气还原氧化铜应该在硬质试管中加热.
解答 解:A.铜与稀硝酸在常温下反应生成一氧化氮,反应不需要加热,用排水法收集,用到的仪器有:大试管、带导管的单孔塞、药匙、镊子、水槽、集气瓶、玻璃片、铁架台,故A正确;
B.制取乙烯需要用温度计控制温度,而所给仪器中没有温度计无法制取,故B错误;
C.制取乙炔是将饱和食盐水加入到电石上,应用到双孔塞,故C错误;
D.氢气还原氧化铜应该在硬质试管中加热,所给仪器中没有硬质试管,不能完成,故D错误;
故选:A.
点评 本题考查了实验仪器的选择,明确实验原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 容器内的密度不再变化 | |
| B. | C的生成速率与A的分解速率之比为2:1 | |
| C. | 混合物的平均摩尔质量不再变化 | |
| D. | 容器内的温度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe电极作阳极,发生氧化反应 | |
| B. | Cl-向石墨极作定向运动 | |
| C. | 石墨电极反应:Fe3++3e-═Fe | |
| D. | 电解池发生总反应:2Cl${\;}_{\;}^{-}$+2Fe3+═Cl2+2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | B. | CS2的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 苯的分子式: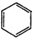 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.
CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有1molFe(OH)3的氢氧化铁胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 1mol-L-1Na2CO3溶液100mL,含有0.1NA个CO32- | |
| C. | 足量的铁与1molCl2充分反映转移的电子数为3NA | |
| D. | 高温常压下,22.4L的一氯甲烷中含有的分子数小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①溶液逐渐变红色的原因是Fe2+被酸性KMnO4溶液氧化 | |
| B. | ②红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化 | |
| C. | ②红色逐渐褪去的原因是酸性KMnO4溶液将Cl-氧化 | |
| D. | ③溶液又逐渐变色且为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
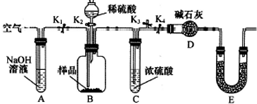 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com