
| A. | Cl | B. | S | C. | P | D. | Si |
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
 关于如图所示装置的叙述:①Zn为正极,Cu为负极;②溶液中氢离子向负极移动;③电子从锌片经导线流向铜片;④铜极上有氢气产生;⑤若有0.1mol电子流过导线时,锌片质量减轻6.5g;⑥若有1mol电子流过导线,则产生的氢气为0.5mol.正确的是( )
关于如图所示装置的叙述:①Zn为正极,Cu为负极;②溶液中氢离子向负极移动;③电子从锌片经导线流向铜片;④铜极上有氢气产生;⑤若有0.1mol电子流过导线时,锌片质量减轻6.5g;⑥若有1mol电子流过导线,则产生的氢气为0.5mol.正确的是( )| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
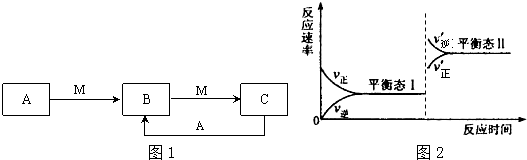
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 离子化合物中只含离子键 | |
| D. | 只含共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na被氧化完全转化生成Na2O2,失去电子数为2NA | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 将lmL 1 mol•L-1FeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目是1×10-3NA | |
| D. | 标准状况下,6.72L NO2与足量水充分反应转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | |
| C. | 往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 含等物质的量浓度的CH3COOH和CH3COONa混合溶液中:2c(H+)-c(CH3COO-)=2c(OH-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1 mol H-H的同时断开2 mol N-H | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶事先未烘干 | B. | 定容时观察液面仰视 | ||
| C. | 定容时观察液面俯视 | D. | 定容,摇匀后有少量液体流出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com