
分析 (1)依据铝的化合物性质结合转化关系分析判断,Al3+$\stackrel{OH-}{→}$Al(OH)3$\stackrel{OH-}{→}$AlO2-$\stackrel{Al_{3}+}{→}$Al(OH)3;AlO2-$\stackrel{H+}{→}$Al(OH)3$\stackrel{H+}{→}$Al3+$\stackrel{AlO_{2}-}{→}$Al(OH)3;
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,推断A为NaOH,M为CO2,转化关系为:NaOH$\stackrel{CO_{2}}{→}$Na2CO3$\stackrel{CO_{2}}{→}$Na2HCO3$\stackrel{NaOH}{→}$Na2CO3;
(3)A是一种黄绿色气体,判断A为Cl2,M是一种常见金属.符合转化关系的是Fe,Cl2$\stackrel{Fe}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3;
(4)依据盖斯定律,A转化为B的热化学方程式×3减去A转化为C的热化学方程式,再将各系数除以2可得A与C反应转化为B的热化学方程式;
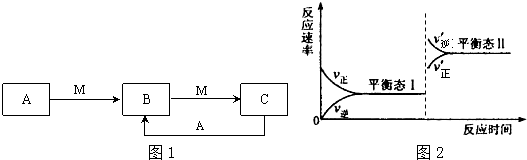
(5)分析图象可知升温,平衡逆向进行,依据平衡移动原理分析判断反应热量变化,反应逆向进行,平衡常数减小.
解答 解:(1)依据铝的化合物性质结合转化关系分析判断,Al3+$\stackrel{OH-}{→}$Al(OH)3$\stackrel{OH-}{→}$AlO2-$\stackrel{Al_{3}+}{→}$Al(OH)3;AlO2-$\stackrel{H+}{→}$Al(OH)3$\stackrel{H+}{→}$Al3+$\stackrel{AlO_{2}-}{→}$Al(OH)3,判断M可以是NaOH溶液或盐酸,
故答案为:NaOH溶液或盐酸;
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,推断A为NaOH,M为CO2,转化关系为:NaOH$\stackrel{CO_{2}}{→}$Na2CO3$\stackrel{CO_{2}}{→}$Na2HCO3$\stackrel{NaOH}{→}$Na2CO3,判断C为NaHCO3,
故答案为:NaHCO3;
(3)A是一种黄绿色气体,判断A为Cl2,M是一种常见金属.符合转化关系的是Fe,Cl2$\stackrel{Fe}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3,C→B的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-a kJmol-1;
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-b kJmol-1;
由盖斯定律$\frac{①×3-②}{2}$得到A(H2S)与C(SO2)反应转化为B(S)的热化学方程式为:2H2S(g)+2SO2(g)=3S (g)+2H2O(l)△H=-(3a-b)/2 kJmol-1,
故答案为:2H2S(g)+2SO2(g)=3S (g)+2H2O(l)△H=-(3a-b)/2 kJmol-1;
(5)图象可知升温,平衡逆向进行,依据平衡移动原理分析判断反应热量变化,反应逆向进行,平衡常数减小,故答案为:放热;减小.
点评 本题考查无机物推断,难度不大,需要学生熟练掌握元素化合物知识,注意把握中学常见连续反应.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然引起物质状态的变化 | B. | 化学反应会引起化学键的变化 | ||
| C. | 化学反应必然伴随着能量的变化 | D. | 化学反应会产生新的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L H2含有的原子数为NA | |
| B. | 等质量的O2和O3中所含的氧原子数相等 | |
| C. | 同温同压下,相同体积的H2和O2,其质量比为1:16 | |
| D. | 28g CO与22.4L CO2所含的碳原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲认为上述发现绝对不可能,因为H3分子违背了共价键理论 | |
| B. | 丁认为如果上述的发现存在,则证明传统的价键理论并不完善 | |
| C. | 丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+ | |
| D. | 乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.
某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe 和足量的HCl完全反应失去电子数为0.3 NA | |
| B. | 22.4L O2含有NA个O2分子 | |
| C. | 0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA | |
| D. | 1.6g CH4所含的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com