
分析 (1)常用的水处理剂,可知铁离子水解生成胶体,则为+3价铁;
(2)a.均含金属离子与配位离子之间的离子键,配位离子中含配位键;
b.[Cu(NH3)4]SO4中不存在NH3分子;
c.非金属性最强的为F,其电负性最大;
d.由化学式可知,配位数均为6;
(3)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,根据NH3和NF3中共用电子对的偏转判断;
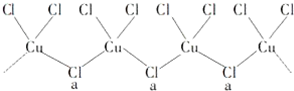
(4)据图知a位置上的Cl原子形成了2个σ键,同时还有2个孤电子对,其杂化轨道类型为sp3杂化;由于铜的化合价有+1、+2,已知KCuCl3中铜为+2价,则+1价的铜形成化合物的化学式为K2CuCl3;
(5)根据铜晶胞为面心立方最密堆积,由边长可计算出晶胞的体积,根据m=ρ×V计算质量,由晶胞可知Cu原子在顶点和面心,以此计算.
解答 解:(1)常用的水处理剂,可知铁离子水解生成胶体,则为+3价铁,26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,则铁离子的电子排布为1s22s22p63s23p63d5或[Ar]3d5,
故答案为:1s22s22p63s23p63d5或[Ar]3d5;
(2)a.[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3AlF6都为配合物,晶体中存在化学键类型为配位键和金属离子与配位离子之间的离子键,故a正确;
b.[Cu(NH3)4]SO4中铜离子和氨分子之间形成配位键,不存在NH3分子,其水溶液中也不含有大量NH3分子,故b错误;
c.三种物质的组成元素中第一电离能最大的是氟元素,故c错误;
d.K4[Fe(CN)6]与Na3[AlF6]的中心离子具有相同的配位数,均为6,故d正确;
故答案为:ad;
(3)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键,
故答案为:N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键;
(4)a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为:sp3,
一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,CuCl3原子团的化合价为-2,其化学式为K2CuCl3,
故答案为:sp3;K2CuCl3;
(5)根据铜晶胞为面心立方最密堆积,由边长可计算出晶胞的体积V=(361 pm)3≈4.70×10-23 cm3,根据m=ρ×V=9.00 g•cm-3×4.70×10-23cm3=4.23×10-22g;
由于一个铜晶胞中含有的铜原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4(个),每个铜原子的体积约为=4.70×10-23 cm3÷4=1.18×10-23 cm3,则$\frac{1}{6}$×π×d3=1.18×10-23 cm3,解得铜原子的直径d≈255pm;NA=$\frac{63.6g/mol}{\frac{1}{4}×4.23×1{0}^{-22}g}$≈6.05×1023mol-1,
故答案为:255;6.05×1023.
点评 本题考查物质结构与性质的考查,涉及电子排布、杂化及晶胞计算等,综合性较强,掌握杂化轨道理论以及铜晶胞堆积方式是解答关键,题目难度较大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 用锌和稀硫酸反应制取氢气 | B. | 用氢气高温还原氧化铜得到单质铜 | ||
| C. | 用碳和高温水蒸气反应制取氢气 | D. | 用氯气和溴化钠溶液反应制取溴 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:填空题
浊液、胶体、溶液三种分散系的本质区别为分散质粒子的大小。如下图A、B、C分别代表分散质粒子。

把10 mL淀粉胶体和5mLKCl溶液的混合液加入用半透膜制成的袋内,将此袋浸入盛有蒸馏水的烧杯中。2min后,用两支试管各取烧杯中的液体5mL,并做如下实验:
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是_______________。
(2)向另一支试管里滴加少量的碘水,其现象是________________。
(3)由上述实验得出的结论是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
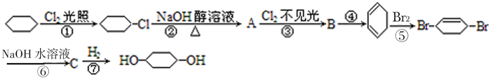
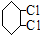 C:
C:
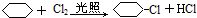 ;④:
;④: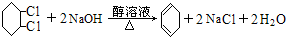 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
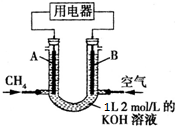
| A. | 通入CH4的一端为原电池的负极,溶液中OH-向负极区移动 | |
| B. | 当0<V≤22.4L时,电池总反应式为CH4+2O2+2KOH═K2CO3+3H2O | |
| C. | 当22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO32-+3H2O═10HCO3- | |
| D. | 当V=33.6L时,溶液中阴离子浓度大小关系为c(CO32- )>c(HCO3-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质的分子式是C8H10ClO | |
| B. | 1 mol该物质最多可以与2 mol NaOH反应 | |
| C. | 1 mol该物质可以与2 mol液溴发生取代反应 | |
| D. | 该物质可以发生加成、取代、消去、氧化等反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com