
����Ŀ����п�������Ĺ�ҵ��������п��(���˺�Zn �⣬������Fe��Al��Cd ���ӣ���SiO2������)������п����ȡ������ZnSO4��7H2O �ͽ�����(Cd)��һ������ij��ԣ��������£�
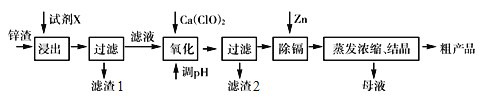
��֪���������Zn> Cd
���� | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Cd(OH)2 | Fe(OH)2 |
��ȫ����ʱ��PH | ��3.2 | ��4.7 | ��6.5 | ��9.4 | ��9.7 |
�Իش��������⣺
(1)��һ������ʱ�õ����Լ�XΪ__________������1�ijɷ���___________��
(2)����Ca(ClO)2 ��Ŀ��������Fe2+��д����Ӧ�����ӷ���ʽ____________________��
(3)����pH ���̿���ѡ�ã������̵�pH ����һ�����5����Ŀ����_____________________��
(4)д�����˺���������п�۷�Ӧ�����ӷ���ʽ__________________��
(5)������Ũ������ʱ��Ҫ����һ������ȣ���Ŀ����______��
���𰸡� H2SO4��Һ SiO2 2H++ClO��+2Fe2+ =Cl��+2Fe3++H2O ZnO��ȥFe3+��Al3+����ֹZn2+�������� Zn+Cd2+== Zn2++Cd ��ֹZn2+ˮ��
��������(1).Zn��Fe��Al��Cd��SiO2�У�ֻ�ж������費�ܺ����ᷴӦ�����������Ὣ֮�ܽ⣬���ˣ��Ȼ�ö������裬�ʴ�Ϊ��H2SO4��Һ��SiO2��
(2).Ϊ�˽������������Լ����������ӳ���������������ӳ���������������Ҫ��������������Ϊ������������Ȼ���ٽ�֮�γɳ�������Ӧʵ���ǣ�2H++ClO-+2Fe2+ =Cl-+2Fe3++H2O���ʴ�Ϊ��2H++ClO-+2Fe2+ =Cl-+2Fe3++H2O��
(3).������pH��������ʹ����Һ�ļ�����ǿ��ͬʱ�ֲ��������������ӣ��ݴ˿���ѡ������п�����Լ����Խ����������Ӻ������ӳ����������γ�Fe(OH)3��Al(OH)3��ͬʱ�����Է�ֹZn2+�����������ʴ�Ϊ��ZnO����ȥFe3+��Al3+����ֹZn2+����������
(4).����Cd�Ļ����ԱȽ���п������ý���п���û�����������Ӧ�����ӷ���ʽΪ��Zn+Cd2+== Zn2++Cd���ʴ�Ϊ��Zn+Cd2+== Zn2++Cd��
(5).������п��Һ�л�ô���������п�ľ���ķ����Ǽ���Ũ������ȴ�ᾧ��������ϴ�ӣ�����Ҫע�Ᵽ����Һһ������ȣ��Է�ֹZn2+��ˮ�⣬�ʴ�Ϊ����ֹZn2+ˮ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����Ҫ�ӻ�ԭ��ʵ�ֵ��ǣ� ��
A. Fe2+��Fe3+ B. H2O2�� O2 C. Cl2 ��2Cl�� D. CO2 ��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������ṹ��ʽ��CH3��CH3�͡�CH3 �� ��ʽ���ж��ߡ���������������������ʾ��������(����)
A.����ʾһ�Թ��õ��Ӷ�
B.����ʾһ�����۵���
C.ǰ�߱�ʾһ�Թ��õ��Ӷԣ����߱�ʾһ��δ�ɶԵ���
D.ǰ�߱�ʾ������ֻ��һ�����۵��������߱�ʾ�û��������۵���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.������ȼ����Ϊ��H=��285.5kJ?mol��1 �� ����ˮ���Ȼ�ѧ����ʽΪ2H2O��l�� ![]() 2H2��g��+O2��g����H=+285.5k?Jmol��1
2H2��g��+O2��g����H=+285.5k?Jmol��1
B.��ӦSO2��g��+2H2S��g���T3S��s��+2H2O��l���ڳ��������Է����У���÷�Ӧ�ġ�H��0
C.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g���T2NH3��g����H=��38.6k?Jmol��1
D.��C��ʯī��s��=C�����ʯ��s����H=+1.90 k?Jmol��1��֪�����ʯ��ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.[Cu(NH3)4]SO4��ͨ��CuSO4��Һ�������ˮ���õõ�
B.�������Ҫ�ɷֿɱ�ʾΪFe2O3��nH2O
C.�Ƶ��ʿ��Դ�TiCl4���û���Ti
D.����H2��ԭMgO�Ʊ�����Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.��ҵ����ʯ�����Ʊ�Ư�ۣ�Ca��OH��2+Cl2=Ca2++ClO��+Cl��+H2O
B.�����������Һ�еμ�����Ba��OH��2��Һ��NH4++Al3++2SO42��+2Ba2++5OH��=AlO2��+2BaSO4��+NH3H2O+2H2O
C.�Ʊ�Fe��OH��3���壺Fe3++3H2OFe��OH��3�����壩+3H+
D.��Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO4��+6H++5H2O2=2Mn2++5O2��+8H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ܱ������������淴ӦZ������+W������X��g��+Y��������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ���ǣ� �� 
A.Z��W�ڸ�������������һ����Ϊ��̬
B.t1��t2ʱ�����t3ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ���������������
C.���÷�Ӧֻ��ij�¶�T0�����Է����У���÷�Ӧ��ƽ�ⳣ��K���¶����߶�����
D.���ڸ��¶��´˷�Ӧƽ�ⳣ������ʽΪK=c��X������t1��t2ʱ�����t3ʱ�̺��XŨ�Ȳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±������ķ���ʽ���й��ɣ��жϿո�������ͬ���칹�����Ŀ��(����)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�RO ![]() ��R���ɷ�����Ӧ��RO
��R���ɷ�����Ӧ��RO ![]() +5R��+6H+�T3R2+3H2O�����й���RԪ�ص������У���ȷ���ǣ� ��
+5R��+6H+�T3R2+3H2O�����й���RԪ�ص������У���ȷ���ǣ� ��
A.Ԫ��Rλ�����ڱ��еڢ�A��
B.R�����ǽ���
C.R�γɵĵ����ڳ��³�ѹ��һ��������
D.��Ӧ�����������뻹ԭ��������ʵ���֮����5��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com