
【题目】下列过程需要加还原剂实现的是( )
A. Fe2+→Fe3+ B. H2O2→ O2 C. Cl2 →2Cl- D. CO2 →CO32-
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.NH3 ![]() NO
NO ![]() NaNO2
NaNO2
B.Fe2O3 ![]() Fe
Fe ![]() FeCl3
FeCl3
C.SiO2 ![]() H2SiO3(aq)
H2SiO3(aq) ![]() Na2SiO3
Na2SiO3
D.CuCl2(aq) ![]() Cu(OH)2
Cu(OH)2 ![]() Cu2O
Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“野火烧不尽,春风吹又生”是唐代诗人白居易的若名诗句。下列关于该诗句中所涉及的说法不正确的是
A.“野火烧”属于生物质能的热化学转换
B.自然界中“春风吹又生”涉及到太阳能与化学能之间的转化
C.诗句“春风吹又生”说明生物质能属于可再生的新能源
D.野草成份中的纤维素属于有机物,而火烧后草木灰中的主要成份K2CO3属于盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(____)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO2及2PbCO3Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料.
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到.
①Pb(NO3)2被氧化为PbO2的离子方程式为 .
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K=1已知:Ksp(PbS)=3.55×10﹣28;H2S电离常数Ka1=1.3×10﹣7 , Ka2=7.1×10﹣15].
(2)制备碱式碳酸铅的实验步骤如图1: 
①“碳化”时,发生反应的化学方程式为 .
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 .
(3)为确定2PbCO3Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图2所示.
①A→B过程中,从体系中逸出的分解产物(化合物)为(填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为(填化学式).
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
A.分子中的C、H、O的个数比为1∶2∶3
B.分子中C、H个数比为1∶2
C.该有机物的相对分子质量为14
D.该分子中肯定不含氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯酮(CH2 =C=O)在一定条件下,能与含活泼氢的化合物发生如下的加成反应:CH2 =C=O+HA→![]() 。乙烯酮在一定条件下与下列试剂加成,其加成产物不正确的是( )
。乙烯酮在一定条件下与下列试剂加成,其加成产物不正确的是( )
A. 与HCl加成:![]()
B. 与CH3COOH加成:![]()
C. 与H2O加成:![]()
D. 与CH3CH2OH加成:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂产生的工业废渣——锌渣(除了含Zn 外,还含有Fe、Al、Cd (镉)和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O 和金属镉(Cd)是一个有益的尝试,流程如下:
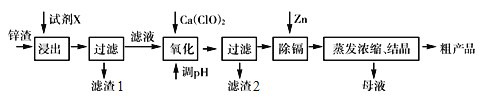
已知:金属活动性Zn> Cd
物质 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Cd(OH)2 | Fe(OH)2 |
完全沉淀时的PH | ≥3.2 | ≥4.7 | ≥6.5 | ≥9.4 | ≥9.7 |
试回答下列问题:
(1)第一步浸出时用到的试剂X为__________,滤渣1的成分是___________。
(2)加入Ca(ClO)2 的目的是氧化Fe2+,写出反应的离子方程式____________________。
(3)调节pH 过程可以选用;本流程的pH 调节一般调至5,其目的是_____________________。
(4)写出过滤后加入过量的锌粉反应的离子方程式__________________。
(5)在蒸发浓缩操作时,要保持一定的酸度,其目的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com