
【题目】用AG表示溶液酸度:![]() 。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是

A. 0.1molL-1的CH3 COOH溶液的pH=3.4
B. A点加入的NaOH溶液的体积为20.00mL
C. 滴定过程中,c(CH3COO-)/c(H+)逐渐减小
D. B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+)
【答案】D
【解析】
室温下,用0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,发生的反应为NaOH+CH3 COOH=CH3 COONa+H2O,化学计量点时恰好生成CH3 COONa,水解使溶液碱性,此时消耗NaOH的体积为20.00mL,结合图象和溶液中的守恒思想分析判断。
室温下,用0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,发生的反应为NaOH+CH3 COOH=CH3 COONa+H2O,化学计量点时恰好生成CH3 COONa,水解使溶液碱性,此时消耗NaOH的体积为20.00mL。
A、滴定起始时,溶液中仅存在醋酸,此时,![]() ,则
,则![]() ,由于Kw=c(H+)c(OH-),则溶液中c(H+)=10-3.3mol/L,因此0.1molL-1的醋酸pH=3.3,选项A错误;
,由于Kw=c(H+)c(OH-),则溶液中c(H+)=10-3.3mol/L,因此0.1molL-1的醋酸pH=3.3,选项A错误;
B、A点时AG=0,c(H+)=c(OH-),加入的NaOH溶液的体积小于20.00mL,若等于20.00mL则溶液应呈碱性AG<0,选项B错误;
C、滴定过程中,发生反应NaOH+CH3 COOH=CH3 COONa+H2O,CH3COO-增大,c(H+)减小,故c(CH3COO-)/c(H+)逐渐增大,选项C错误;
D、B点溶液若完全中和得到醋酸钠,溶液呈碱性,可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+),选项D正确。
答案选D。


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为:C3H8(g) ![]() C3H6(g)+H2(g) ΔH。请回答下列相关问题。
C3H6(g)+H2(g) ΔH。请回答下列相关问题。
(1)下表为部分键能数据,据此可算出△H=_________kJ/mol。
化学键 | C—C | C=C | C—H | H—H |
键能(kJ/mol) | 332 | 611 | 414 | 436 |
(2)一定温度下,向2L的密闭容器中充入2molC3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.4倍。
①0~10 min内氢气的生成速率v(H2)=__________,C3H8的平衡转化率为_________。
②下列情况能说明该反应达到平衡状态的是___________。
A.混合气体的平均分子量保持不变
B. C3H6与H2的物质的量之比保持不变
C.混合气体的密度保持不变
D. C3H8的分解速率与C3H6的消耗速率相等
(3)脱氢反应分别在压强为p1和p2时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。

①压强:p1______p2(填“>”或“<”)。
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是__________。
③若p1=0.1 MPa,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数Kp_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始n(氩气)/n(丙烷)越大,丙烷的平衡转化率越大,其原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
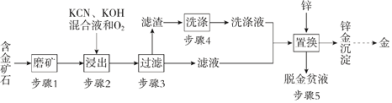
资料:
① Zn + ![]() O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) ![]() Zn(CN)2(s)
Zn(CN)2(s) ![]() Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的H =_______。
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________。
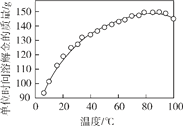
(3)步骤4的目的是_________________。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________(填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e- =2CO32-+12H2O,7H2O+![]() O2+14e- =14OH-,有关此电池的推断正确的是
O2+14e- =14OH-,有关此电池的推断正确的是
A. 电解质溶液中电子向正极移动
B. 放电一段时间后,KOH的物质的量浓度不变
C. 通乙烷的电极为负极
D. 参加反应的O2和C2H6的物质的量之比为2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)_____。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的____。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为 _________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是________。
(3)利用图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于____处(填“M”或“N”);若X为锌,开关K置于M处,该电化学防护法称为_______。
(4)已知:H2O2是弱酸,在碱性条件下以HO2-存在。目前研究比较热门的Al-H2O2燃料电池,其原理如下图所示:

电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O 。写出负极反应式为_______;写出正极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛的应用。

上图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为________,在X极附近观察到的现象是__________________________ 。电解液中向X极方向移动的离子是______。
②检验Y电极反应产物的方法是________________
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________
②溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电解池盛放的电镀液必须含有浓度较高的________(要求填电解质溶液中所含的阳离子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是某些姜科植物根茎的提取物,具有抗肿瘤、抗菌、抗氧化等功效,其一种合成路线如下:

已知:i 质谱图显示有机物D的最大质荷比为94,且D遇FeCl3溶液显紫色
ii RMgBr+R′CHO→![]()
回答下列问题:
(1)D的化学式为___________;B的名称为___________。
(2)反应①的反应类型是___________:I中所含官能团的名称为___________。
(3)反应④的化学方程式是______________________。
(4)X是H的同系物,其相对分子质量比H小14,则X的同分异构体中,符合下列条件的有___________种(不含立体异构)
a.属于芳香族化合物 b.能发生水解反应 c.能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的结构简式是___________(写一种即可)。
(5)补充完成由甲苯和丙醛为原料,制备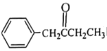 的合成路线(无机试剂任选)
的合成路线(无机试剂任选) ____________
____________ 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电离方程式:① HCl=_____,② NaOH=___,③ NaCl =_______,④ H2SO![]() =____。
=____。
(2)选择下列实验方法分离物质,将分离方法的字母填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.蒸馏法 F.过滤法
①________分离饱和食盐水和沙子的混合物;
②________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
③________分离水和汽油的混合物;
④________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com