
【题目】电解原理在化学工业中有广泛的应用。

上图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为________,在X极附近观察到的现象是__________________________ 。电解液中向X极方向移动的离子是______。
②检验Y电极反应产物的方法是________________
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________
②溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电解池盛放的电镀液必须含有浓度较高的________(要求填电解质溶液中所含的阳离子)。
【答案】2H++2e-=H2↑ 有无色气泡产生,溶液会变红 Na+和H+ 将湿润的淀粉碘化钾试纸接近出气口,如果试纸变蓝说明生成氯气 纯铜 变小 Zn2+
【解析】
(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,X为阴极,电极上氢离子放电生成氢气。
②Y电极上产生氯气,氯气可以用湿润的淀粉碘化钾试纸检验。
(2)①如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则阳极应该是粗铜,阴极是纯铜。
②该电解池的阳极材料是粗铜,参与放电的是金属锌、铁、铜等金属,在阴极上一直是铜离子得电子的还原反应,溶液中的c(Cu2+)与电解前相比减少。
(3)铁上镀锌,镀层金属锌作阳极,镀件金属铁作阴极,含Zn2+的溶液作为电解质溶液。
(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,X为阴极,电极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,同时该电极附近生成氢氧根离子,遇到酚酞试液会变红,电解质溶液中阳离子向阴极定向移动,所以向X极方向移动的离子是Na+和H+,故答案为:2H++2e-=H2↑;有无色气泡产生,溶液会变红;Na+和H+。
②Y电极上产生氯气,氯气具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以氯气可以用湿润的淀粉碘化钾试纸检验,故答案为:将湿润的淀粉碘化钾试纸接近出气口,如果试纸变蓝说明生成氯气。
(2)①如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则阳极应该是粗铜,阴极是纯铜,则X是纯铜,Y是粗铜,故答案为:纯铜。
②该电解池的阳极材料是粗铜,参与放电的是金属锌、铁、铜等金属,在阴极上一直是铜离子得电子的还原反应,溶液中的c(Cu2+)与电解前相比减少,故答案为:变小。
(3)铁上镀锌,镀层金属锌作阳极,镀件金属铁作阴极,阴极发生反应为:Zn2++2e-=Zn,电镀液中含有镀层金属阳离子的盐溶液,可以是ZnCl2溶液或ZnSO4溶液,故答案为:Zn2+。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. CH3COOH = CH3COO- + H+ B. NaOH = Na+ + OH-
C. KClO3![]() K+ + ClO3- D. BaSO4 = Ba2+ + S2- +4O2-
K+ + ClO3- D. BaSO4 = Ba2+ + S2- +4O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AG表示溶液酸度:![]() 。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是

A. 0.1molL-1的CH3 COOH溶液的pH=3.4
B. A点加入的NaOH溶液的体积为20.00mL
C. 滴定过程中,c(CH3COO-)/c(H+)逐渐减小
D. B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:

则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置能达到实验目的的是
A.  分离CH3COOH和CH3COOC2H5混合液
分离CH3COOH和CH3COOC2H5混合液
B.  验证NH4NO3晶体溶于水的热效应
验证NH4NO3晶体溶于水的热效应
C.  蒸发FeCl3溶液得到FeCl3固体
蒸发FeCl3溶液得到FeCl3固体
D. 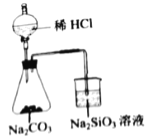 验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小 B. BaO量不变
C. 氧气压强变大 D. BaO2量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是实验室常用的部分仪器,请回答下列问题:

(1)序号为⑧和⑩的仪器的名称分别为________、________。
(2)在分液操作中,必须用到上述仪器中的________(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)配制一定物质的量浓度的溶液时要用到的仪器是________(填序号)。
(5)仪器上标有温度的有________(填序号)。
(6)如图是温度计、量筒、滴定管的一部分,下述读数(虚线对应刻度)及说法正确的是________。

A.①是量筒,读数为2.5 mLB.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mLD.②是温度计,读数为2.5 ℃
(7)

a.图中有两处明显的错误是:①________;②________。
b.A仪器的名称是________,B仪器的名称是________。
c.实验时A中除加入少量自来水外,还需要加入少量的________,其作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R的钠盐溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(ɑ)随溶液pH变化关系如图所示,下列叙述不正确的是

A. H2R属于二元弱酸
B. pH=8时,溶液中c(Na+)>c(R2-)>c(HR-)>c(OH-)>c(H+)
C. 若c(H2R)+2c(R2-)+c(OH-)=c(H+),则pH一定小于2
D. 配制c(R2-)=c(HR-)的钠盐溶液应控制溶液的pH=7.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com